С помощью какой бактерии получают культуры бородатых корней
Опубликовано: 17.09.2024
CC BY
Аннотация научной статьи по биологическим наукам, автор научной работы — Матвеева Н. А., Кищенко Е. М., Шаховский А. М., Кучук Н. В.
Показана возможность быстрого получения культуры «бородатых корней» цикория Cichorium intybus L. var foliosum Hegi с генами туберкулезных антигенов ESAT6 и Ag85B Mycobacterium tuberculosis или геном интерферона α2b человека после генетической трансформации с помощью Agrobacterium rhi zogenes. Полученные «бородатые корни» имели типичный фенотип и росли на питательной среде без регуляторов роста. Частота генетической трансформации составила 42,3% при трансформации конструкцией рСВ161 с геном ifnα 2b и 5,9% с использованием вектора рСВ158 со слитой последовательностью esxA::fbpB Δ TMD генов туберкулезных антигенов. ПЦР и ОT–ПЦРанализы подтвердили присутствие и транскрипцию селективного nptII и целевых генов fbpB Δ TMD , ifnα 2b в трансформированных корнях. Согласно с результатами ПЦР все проанализированные корневые линии цикория содержали перенесенный T Lфрагмент ТДНК плазмиды pRi А4. Трансгенные корни, так же как и нетрансформированные, накапливали инулин — запасной полисахарид, синтез которого характерен для растений цикория. Содержание инулина в одной из полученных трансгенных корневых линий был в 1,7 раза выше, чем в контроле, и превышал 20% сухой массы.
Похожие темы научных работ по биологическим наукам , автор научной работы — Матвеева Н. А., Кищенко Е. М., Шаховский А. М., Кучук Н. В.
INULIN SYNTHESIS IN CHIHORY HAIRY ROOTS TRANSFORMED WITH Agrobacterium rhizogene s 1Institute of Cell Biology and Genetic Engineering of National Academy of Sciences of Ukraine
A fast reproducible transformation procedure employing Agrobacterium rhizogenes with genes of tuberculosis antigens ESAT6 and Ag85B from Mycobacterium tuberculosis or human interferon αб2b was developed for Cichorium intybus L. var foliosum Hegi. Obtained hairy roots have typical phenotype and were able to growth on hormonefree nutrient medium. Frequency of genetic transformation was 42.3% for construction рСВ161 with ifn α 2b gene and 5.9% when vector рСВ158 harbouring fused sequence of esxA::fbpB Δ TMD genes coding for tuberculosis antigens was used. PCR and RTPCR analysis have shown the presence and transcription of both selective nptII and target fbpB Δ TMD , ifnα 2b genes in transformed hairy root lines. According to PCR data, all the analysed chicory root lines transferred T Lfragment ТDNA plasmid pRi А4. Transgenic roots like untransformed ones accumulated inulin natural chicory, reserve polysaccharide, which synthesis is typical for chicory plants. The content of inulin in one of the obtained transgenic root lines was in 1.7 times more than in the control root line and was over 20% of dry weight.
Текст научной работы на тему «Синтез инулина «Бородатыми корнями» цикория, трансформированного с помощью Agrobacterium rhizogene S»
СИНТЕЗ ІНУЛІНУ В «БОРОДАТИХ КОРЕНЯХ» ЦИКОРІЮ, ТРАНСФОРМОВАНОГО ЗА ДОПОМОГОЮ Agrobacterium rhizogenes
О. М. Кіщенко Інститут клітинної біології та генетичної інженерії
А. М. Шаховський НАН України, Київ
Показано можливість швидкого одержання культури «бородатих коренів» цикорію Cichorium intybus L. var foliosum Hegi з генами туберкульозних антигенів ESAT6 та Ag85B Mycobacterium tuberculosis або геном інтерферону a2b людини після генетичної трансформації за допомогою Agrobacterium rhizogenes. Отримані «бородаті корені» мали типовий фенотип та росли на живильному середовищі без регуляторів росту. Частота генетичної трансформації становила 42,3% при трансформуванні конструкцією рСВ161 з геном ifn-a2b та 5,9% з використанням вектора рСВ158 зі злитою послідовністю esxA::fbpB&TMD генів туберкульозних антигенів. ПЛР- та BT-ПЛР-аналізи підтвердили присутність і транскрипцію селективного nptII та цільових fbpB&TMD, ifn-a2b генів у трансформованих коренях. Згідно з результатами ПЛР усі проаналізовані кореневі лінії цикорію містили перенесений ^-фрагмент Т-ДНК плазміди pRi А4. Трансгенні корені, так само як і нетранс-формовані, накопичували інулін — запасний полісахарид, синтез якого є характерним для рослин цикорію. Вміст інуліну в одній з отриманих трансгенних кореневих ліній був у 1,7 раза вищий, ніж у контролі, й перевищував 20% сухої маси.
Ключові слова: інулін, Cichorium intybus, Agrobacterium rhizogenes, генетична трансформація, гени туберкульозних антигенів ESAT6 та Ag85B, ген інтерферону ifn-a2b.
Цикорій Cichorium intybus L. росте в помірному і тропічному кліматі Євразії та на півночі Африки. Кореневі й листові форми цикорію культивують і застосовують у сільському господарстві для виробництва замінника кави та отримання інуліну [1]. Листові сорти, що відомі у Бельгії, Франції, СТТТА, використовують як салатні рослини, окрім того вони мають лікарські властивості (нормалізація обміну кальцію та ліпідів [2, 3], лікування діабету [4], дисбактеріозів [5] тощо [6]).
Запасною сполукою, що синтезується в цикорії й зумовлює наявність лікувальних властивостей, є інулін — полісахарид, який має термінальну молекулу глюкози та ланцюг із фруктозних залишків. Інулін виробляють із цикорію бельгійські компанії Beneo-Orafti та Cosucra, голландська компанія Sensus, а також Shandong Baolingbao Biotechnology Co. Ltd., Guangzhou Zeyu Biotechnology Co. Ltd, Shanghai Winway Biotech Co. Ltd — з Китаю [7, 8]. Застосовують його у медицині та промисловості. У росли-
нах цикорію інулін знайдено в листках, але переважна кількість його накопичується в коренях [1]. У культурі in vitro в рослинах цикорію теж відбувається синтез інуліну
[9]. Одним зі способів отримання інуліну може бути культура коренів, що продукує цей полісахарид. Корені, які мають здатність до росту в середовищі без регуляторів росту, можна одержати генетичною трансформацією за допомогою Agrobacterium rhizogenes
[10]. Разом з тим практичний інтерес становить отримання «бородатих коренів» цикорію, які крім інуліну (природного продукту) синтезують ще й інші сполуки, зокрема інтерферон та бактеріальні антигени.
Трансформація за допомогою A. rhizogenes є досить зручним способом зміни рослинного геному, адже бактерія може переносити не тільки власну Т-ДНК онкоплазміди рRi, але й Т-ДНК бінарних векторів із селективними та цільовими генами [11, 12]. Корені, отримані після трансформації рослин за допомогою A. rhizogenes, накопичують вторинні метаболіти або запасні сполуки,
які властиві для тієї чи іншої рослини [1З-16], причому в трансформованих коренях вміст таких сполук може бути вищий порівняно з рослинами дикого типу. Так, концентрація полісахаридів у трансгенних коренях Echinacea purpurea була вищою, ніж у вихідних рослин [17]. Концентрація вітаноліду (седативної, снодійної та антисептичної речовини) в трансгенних коренях Withania somnifera була більш ніж у 2 рази вищою порівняно з нетрансформованими [18]. A. rhizogenes-опосередкованою трансформацією одержано корені Glycyrrhiza uralensis з підвищеним синтезом флавоноїдів [19]. Трансформовані рослини (корені та регенеровані з трансгенних коренів рослини) є потенційними продуцентами різних речовин [1З], включаючи алкалоїди [2О], вторинні метаболіти [21], фармацевтичні сполуки [22], моноклональні антитіла [2З], а також можуть використовуватися для фіторемедіації [24]. Доцільно було б отримати трансгенні корені цикорію, що мають гени інтерферону й туберкульозних антигенів, і порівняти ефективність синтезу природного метаболіту цикорію — інуліну — в транс-генних та нетрансформованих коренях. Коло досліджень з генетичної трансформації цикорію є досить обмеженим. Так, A. rhizo-genes використовували для одержання рослин цикорію зі зміненим ритмом цвітіння [1О, 25], A. tumefaciens — рослин, стійких до хлорсульфурону [26]. Окрім того, генетичною трансформацією створено рослини цикорію, які синтезують не лише інулін, але й фруктан типу неоінуліну [27]. З використанням A. tumefaciens нами створено трансформовані рослини цикорію з генами антигена ESAT6 Mycobacterium tuberculosis [28] та інтерферону a2b людини [29].
Метою роботи було отримання A. rhizo-genes-опосередкованою трансформацією «бородатих коренів» цикорію, що містять гени туберкульозних антигенів ESAT6 (esxA), Ag85B (fbpB&TMD) або людського лейкоцитарного інтерферону ifn-a2b, та дослідження вмісту інуліну в трансформованих коренях.
Матеріали і методи
Вихідним матеріалом були сім’ядолі 1О-денних проростків цикорію C. intybus L. сорту «Пала росса», які відділяли від рослин та надрізали скальпелем. Трансформацію проводили за допомогою агропінового штаму A. rhizogenes A4 з векторними конструкціями pCB158 [ЗО] і pCB161 [З1]. Вектори
мали відповідно цільові гени: злиту
послідовність esxA::fbpßATMD під контролем коренеспецифічного промотору Mll цукрового буряку та ifn-a2b — промотору гена 358-протеїну з геном вірусу мозаїки цвітної капусти. Вектор pCB161 містив кальрети-куліновий сигнал [32] перед кодувальною частиною гена ifn-a2b для перенаправлення протеїну в ендоплазматичний ретикулюм і далі в апопласт. Обидва вектори містили селективний ген неоміцинфосфотрансфера-зи ІІ (nptII) під контролем промотора гена нопалінсинтетази, наявність якого давала можливість здійснювати відбір трансгенних коренів за ознакою стійкості до канаміцину.
Бактеріальну суспензію вирощували і сім’ядолі рослин цикорію трансформували за методикою, наведеною в статті [29].
Після кокультивування з бактеріальною суспензією експланти переносили на 3 доби на середовище 1/2 МС (Мурасіге — Скуга [33] зі зменшеним удвічі вмістом макроелементів), потім — на селективне середовище 1/2 МС, що містило 25 мг/л канаміцину («Київмедпрепарат», Україна), оскільки раніше [29] таку концентрацію було визначено як селективну, та 600 мг/л цефатокси-му («Дарниця», Україна) для елімінації аг-робактерій. Субкультивування отриманих трансгенних ліній здійснювали кожні 3 тижні шляхом перенесення кінчиків коренів на середовище 1/2 МС з канаміцином та цефатоксимом.
Рослинну ДНК виділяли методом ЦТАБ згідно з [34]. ПЛР геномної ДНК проводили на ампліфікаторі Mastercycler personal 5332 (Eppendorf). Реакційна суміш складалася з однократного ПЛР-буфера із сульфатом амонію,
0,2 мкМ праймерів, 200 мкМ дезоксинуклео-зидтрифосфатів, 0,5 од. Tag-полімерази, 10-50 нг ДНК. Загальний об’єм реакційної суміші становив 20 мкл. Використовували праймери, специфічні до генів nptII, fbpßATMD, ifn-a2b, rolB (таблиця).
Умови ампліфікації: первинна денатурація — 94 °С, 3 хв, 30 циклів ампліфікації (94 °С, 30 с — 62 °С, 30 с — 72 °С, 30 с), заключний синтез — 72 °С, 3 хв (nptII, esxA, ifn-a2b). Для детекції rolB у циклах ампліфікації тривалість синтезу — 40 с (72 °С).
Для доказу транскрибування перенесених генів у трансформованих кореневих ліній проводили полімеразну ланцюгову реакцію, поєднану зі зворотною транскрипцією (ЗТ-ПЛР). Сумарну РНК виділяли за методикою [35]. Препарати сумарної РНК, оброблені ДНКазою I (вільною від РНКази), використовували як матрицю для синтезу
Праймери, що були використані для ПЛР-аналізу присутності генів nptII, fbpBДATMD, rolB, ifn-a2b
Ген Праймери Розмір ампліфікованого фрагмента, п.н.
nptII 5'-cctgaatgaactccaggacgaggca-3' 5/-gctctagatccagagtcccgctcagaag-3/ 622
fbpBiTMD 5/-tctacagcgactggtacagc-3/ 5/-tcaggttgctgctacgaacg-3/ 484
rolB 5/-atggatcccaaattgctattccttccacga-3/ 5/-ttaggcttctttcttcaggtttactgcagc-3/ 780
ifn-a2b 5/-ttgatgctcctggcacag-3/, 5/-ttctgctctgacaacctc-3/ 396
першого ланцюга кДНК (зворотних тран-скриптів). Синтез кДНК здійснювали, застосовуючи набір реактивів Fermentas, за інструкцією фірми-виробника. 5 мкл реакційної суміші слугували матрицею для ПЛР зі специфічними праймерами до відповідного трансгена (таблиця). Аби впевнитися, що проба РНК не містила залишків ДНК, яка може бути матрицею для ПЛР, як негативний контроль застосовували 5 мкл реакційної суміші без ревертази. Сумарну ДНК з агро-бактерій, яку використовували як позитивний контроль в ПЛР, екстрагували за методикою [36].
Вміст інуліну визначали за методикою, що ґрунтується на здатності кетосахарів забарвлюватися резорцином у кислому середовищі [37]. Корені висушували при 100 °С протягом 10 хв та досушували за кімнатної температури до постійної маси. До 100 мг сухого матеріалу додавали по 5 мл дистильованої води, 0,1% спиртового розчину резорцину та концентрованої соляної кислоти, нагрівали на водяній бані 20 хв. Після цього розчини охолоджували і вимірювали інтенсивність забарвлення на ФЕК (КФК-2) із зеленим світлофільтром (540 нм). Концентрацію інуліну визначали за калібрувальною прямою (калібрування за фруктозою).
Результати та обговорення
Застосування методу «листових дисків», за якого експлантами для трансформації слугують частини або цілі листки зі зробленими на них надрізами, є зручним способом генетичної трансформації багатьох рослин за допомогою бактерій роду Agrobacterium (А.. tumefaciens та A. rhizogenes). Наявність такого методу трансформації дає змогу в досить короткий термін отримати трансформовані рослини та корені і не потребує додаткового обладнання [38]. Як експланти для трансформування бактерією A. rhizogenes ми
використовували сім’ядолі проростків цикорію.
Через 10-12 діб на середовищі 1/2 МС з канаміцином та цефатоксимом на сім’ядольних експлантах спостерігали ріст коренів. Корені завдовжки близько 10 мм відділяли від листків і переносили на селективне середовище, що не містило регуляторів росту. Одержані корені характеризувалися швидким ростом, значним галуженням та відсутністю позитивного геотропізму (рис. 1).
Відомо, що частота трансформації залежить від низки чинників, зокрема застосованої конструкції [39]. У наших експериментах частота отримання «бородатих коренів» у разі використання агробактерій з різними конструкціями (за однакових умовах трансформації) була різною. Так, для конструкції рСВ161 корені формувалися на 24 експлантах з 59, а за трансформування агробактерією з конструкцією рСВ158 ріст коренів відбувався тільки на одному із 17. Отже, частота отримання «бородатих коренів» (відносна кількість експлантів з коренями до загальної кількості експлантів у відсотках) для рСВ161 становила 42,3%, а для рСВ158 — 5,9%.
^-фрагмент Т-ДНК плазміди рRi аг-ропінового типу містить гени гоІА, В, С, D, які задіяні в процесі коренеутворення і відповідають за фенотип «бородатих коренів» [40, 41]. Для підтвердження факту перенесення ^-фрагмента Т-ДНК плазміди pRi до коренів цикорію проводили ампліфікацію сумарної ДНК з використанням прай-мерів, специфічних до гена гоІВ. У результаті ампліфікації фрагмент ДНК розміром 780 п. н. знайдено в усіх аналізованих зразках, трансформованих як конструкцією рСВ161 (8 ліній), так і рСВ158 (1 лінія) (рис. 2, а). Таким чином, в усіх аналізованих лініях дійсно відбулося перенесення Т^ фрагмента Т-ДНК плазміди pRi, що й зумовило утворення гормононезалежних коренів типового фенотипу.
Рис. 1. Ріст «бородатих коренів» цикорію на середовищі без регуляторів росту (а) та електрофореграма результатів ампліфікації ДНК «бородатих коренів» цикорію з використанням праймерів до гена rolB (б): 1 — позитивний контроль, сумарна ДНК A. rhizogenes; 2-6 — сумарна ДНК «бородатих коренів»; 7 — ДНК вихідної нетрансформованої рослини; 8 -маркер (GibcoBRL)
ПЛР-аналіз тотальної ДНК коренів, отриманих після трансформації A. rhizogenes з вектором рСВ161, виявив присутність як селективного (nptII), так і цільового (ifn-a2b) генів (рис. 2, а). Аналіз коренів, одержаних після трансформації вектором рСВ 158, також показав наявність селективного та цільового генів (рис. 2, б).
Для коренів, трансформованих вектором рСВ161, було проведено вибірковий ПЛР-аналіз зворотних транскриптів селективного та цільового генів. Показано, що в усіх чотирьох аналізованих лініях відбувалася транскрипція цих генів (рис. 3). Таким чином, в аналізованих лініях не зафіксовано так званого явища мовчання генів, яке ми раніше спостерігали під час трансформації рослин салату і цикорію конструкціями з
генами туберкульозних антигенів esxA, fbpB&TMD та інтерферону [31, 32].
Використання A. rhizogenes та створення «бородатих коренів» дає змогу отримувати сполуки, що синтезуються рослинами в природних умовах. Таким трансформованим кореням притаманний швидкий ріст, а отже й накопичення біомаси [42]. Крім того, технологія їх культивування in vitro є маловитратною, адже трансформовані корені ростуть на «мінімальному» середовищі (без регуляторів росту, зі зменшеним вмістом макро- та мікроелементів), не потребують освітлення. Такі особливості привертають увагу до культури «бородатих коренів» як продуцентів низки сполук, у тому числі тих, що мають лікарські властивості.
Научный журнал «Вестник Томского государственного университета. Биология» [Vestnik Tomskogo Gosudarstvennogo Universiteta. Biologiya = Tomsk State University Journal of Biology] издается Томским государственным университетом.
Журнал публикует результаты завершенных оригинальных исследований (теоретические и экспериментальные статьи) в различных областях современной биологии (физико-химическая биология, общая биология, нормальная физиология), ранее нигде не публиковавшиеся и не представленные к публикации в другом издании. Публикуются описания принципиально новых методов исследования, обзорные статьи по отдельным проблемам (с учетом современных и актуальных исследований).
Решение о публикации принимается научной редакцией после рецензирования, учитывая актуальность проблемы, научную и практическую новизну и значимость, профессионализм выполнения работы, в том числе и статистическую обработку материалов исследования данных, анализ полученных результатов с опубликованными работами, а также качество подготовки, написания и оформления материала.
Научный журнал является реферируемым, рецензируемым, включен в "Перечень ведущих рецензируемых научных журналов и изданий, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученых степеней доктора и кандидата наук" (Приказ от 28.12.2018 г., строка № 504 настоящего Приказа) по направлениям 03.00.00 Биологические науки: 03.01.00 - Физико-химическая биология (Физиология растений, Биотехнология), 03.02.00 - Общая биология (Ботаника, Генетика, Гидробиология, Зоология, Ихтиология, Микробиология, Почвоведение, Экология) 03.03.00 - Физиология (Физиология).
Перечень ВАК (редакция от 28.12.2018 г.)
http://vak.ed.gov.ru/documents/10179/0/%D0%9F%D1%80%D0%B8%D0%BB%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5.pdf/7e409e04-1e2a-4eba-85fb-b0cfcaeac153
perechen-vak-28122018.pdf
Индексируется: Web of Science (Biological Abstracts, BIOSIS Previews, Emerging Sources Citation Index, Zoological Record, RSCI) ; Scopus, eLIBRARY.RU; CYBERLENINKA; Google Scholar; Open Academic Journal Index.
Зарегистрирован: Ulrich's Periodicals Directory
Депозитарная политика: SHERPA/RoMEo
Научный журнал « Вестник Томского государственного университета. Биология »:
Выходит ежеквартально: 4 раза в год (февраль-март, май-июнь, август-сентябрь, ноябрь-декабрь).
Статьи публикуются на русском или английском языках.
Средний срок публикации – 3–6 месяцев.
Публикации в журнале осуществляются на некоммерческой основе ( FREE) : никакой оплаты ни до, ни после публикации с авторов не взимается.
Полная версия статьи выставляется на сайте журнала в свободном доступе, а также в различных БД ( OPEN ACCESS)
Содержание номеров журнала, полнотекстовые версии статей и полная информация о журнале (состав редколлегии, состав редсовета, правила рецензирования рукописей для авторов и рецензентов, новости, изменения) доступны на сайте журнала – http://journals.tsu.ru/biology/ [http://journals.tsu.ru//biology/en/]
Основные требования к представляемым рукописям: актуальность, новизна и обоснованность фактического материала, ясность, сжатость изложения, воспроизводимость экспериментальных данных, академическое написание и правильное оформление рукописи (ознакомиться с требованиями к оформлению материалов можно в разделе " Правила оформления ").
Научный журнал «Вестник Томского государственного университета. Биология» выделен в самостоятельное периодическое издание из общенаучного журнала «Вестник Томского государственного университета» в 2007 г.
Журнал зарегистрирован в Федеральной службе по надзору в сфере массовых коммуникаций, связи и охраны культурного наследия (свидетельство о регистрации ПИ № ФС 77-29499 от 27 сентября 2007 г.), ему присвоен международный стандартный номер сериального издания (ISSN 1998-8591).
«Вестник Томского государственного университета. Биология» распространяется только по подписке, его подписной индекс 44024 в объединённом каталоге «Пресса России». Полнотекстовые версии вышедших номеров можно посмотреть в разделе "Архив".
Адрес редакции:
634050, г. Томск, пр. Ленина, 36, ГОУ ВПО «Томский государственный университет», Биологический институт
Главный редактор журнала – д-р биол. наук, проф. Кулижский Сергей Павлинович
Ответственный секретарь редакции журнала – канд. биол. наук Акимова Елена Евгеньевна.
E-mail: biotsu @ rambler . ru , biotsu @ mail . ru

Цена:
Авторы работы:
Научный журнал:
Год выхода:
Текст научной статьи на тему «ГЕНЕТИЧЕСКИ ТРАНСФОРМИРОВАННЫЕ КОРНИ КАК МОДЕЛЬ ИЗУЧЕНИЯ ФИЗИОЛОГИЧЕСКИХ И БИОХИМИЧЕСКИХ ПРОЦЕССОВ КОРНЕВОЙ СИСТЕМЫ ЦЕЛОГО РАСТЕНИЯ»
ФИЗИОЛОГИЯ РАСТЕНИЙ, 2011, том 58, № 5, с. 787-796
ГЕНЕТИЧЕСКИ ТРАНСФОРМИРОВАННЫЕ КОРНИ КАК МОДЕЛЬ ИЗУЧЕНИЯ ФИЗИОЛОГИЧЕСКИХ И БИОХИМИЧЕСКИХ ПРОЦЕССОВ КОРНЕВОЙ СИСТЕМЫ ЦЕЛОГО РАСТЕНИЯ © 2011 г. И. Н. Кузовкина, М. Ю. Вдовитченко
Учреждение Российской академии наук Институт физиологии растений им. К.А.Тимирязева РАН, Москва
Поступила в редакцию 22.02.2011 г.
Изложена последовательность проведения генетической трансформации растений с помощью диких штаммов почвенной бактерии Agrobacterium rhizogenes и последующего получения корней, способных к длительному росту на относительно простых питательных средах, не содержащих ростовых веществ. Приведены основные морфофизиологические и биохимические признаки генетически трансформированных корней и описана технология их культивирования в условиях in vitro. Перечислены способы оптимизации роста длительно культивируемых корней ценных растений и повышения концентрации синтезируемых в них вторичных метаболитов. Дана краткая оценка эффективности использования метода так называемых "искусственных семян" для сохранения ценных линий культивируемых корней и возможности их оздоровления. На основании анализа литературы и результатов собственных исследований определены основные направления использования метода культивирования генетически трансформированных корней в прикладных и фундаментальных исследованиях. Кратко затронут вопрос о терминологии обозначения генетически трансформированных корней в отечественной литературе. Дан перечень основных материалов и оборудования, необходимых для проведения трансформации растений с помощью почвенной бактерии, и поддержания длительного роста полученных в результате корней.
Ключевые слова: Agrobacterium rhizogenes — генетически трансформированные корни — "hairy root culture" —pRi Т-ДНК — "искусственные семена" — пограничные клетки — арбускулярно-микоризные грибы
Существенная роль в успешном развитии современных исследований в области физиологии и биохимии растений принадлежит не только постоянно совершенствующимся аналитическим методам, но и модернизации приемов по созданию модельных систем, позволяющих изучать детали сложных процессов, протекающих в интакт-ном растении. Основным требованием к таким модельным системам, наряду с некоторым упрощением составных элементов, является их максимальная приближенность к событиям, которые происходят в органах целого растения. К числу модельных систем, которые активно использовались в физиологии и биохимии на протяжении прошлого столетия можно отнести культивирование в условиях in vitro клеток, тканей и органов растений. Особое место в этом наборе занимал метод культивирования корней, отделенных от стерильных проростков растений, или метод изо-
Сокращение: РИ — ростовой индекс.
Адрес для корреспонденции: Кузовкина Инна Николаевна. 127276 Москва, Ботаническая ул., 35. Институт физиологии растений им. К.А. Тимирязева РАН. Электронная почта: kuzovkin@ippras.ru
лированных корней растений, который в течение почти полувека значительно уступал методу культивирования клеток и тканей по своей результативности и распространению в физиологических исследованиях. Это объяснялось невозможностью воспроизведения in vitro всего сложного комплекса условий, которые способны обеспечить поддержание длительной ростовой активности изолированных корней многих видов растений. Однако в начале 80-х годов прошлого столетия произошел значительный рывок в развитии данного метода за счет того, что он был обогащен использованием приема целенаправленной генетической модификации растительных клеток с помощью Agrobacterium rhizogenes, позволяющей получать корневые культуры, которые сохраняют способность к длительному росту в условиях in vitro на безгормональных питательных средах.
В основе данного приема лежит уникальный и чисто природный феномен, заключающийся в развитии цепи событий, которые происходят в результате проникновения в поврежденный корневой или прикорневой участок растения грамот-рицательной почвенной бактерии A. rhizogenes. Попадая в поврежденную часть растения, бакте-
рия вступает в контакт с растительной клеткой и интегрирует в ее ядерный геном определенные фрагменты своей плазмидной Т-ДНК, что вызывает активацию неопластического роста в этой части растения. Пролиферация клеток в данном случае проявляется в виде образования массы быстро растущих и ветвящихся адвентивных корней, которые являются признаком заболевания, получившего название "синдром волосатого корня" — "hairy root disease". Отделение апикальных частей образующихся корней при условии соблюдения стерильности позволяет получать хорошо растущую корневую культуру, для поддержания роста которой не требуются экзогенные ростовые вещества. Это связано с тем, что Т-ДНК Ri-плаз-миды (pRi), фрагменты которой интегрируются в ядерный геном растительной клетки, состоит из двух частей — TL и TR, и в ее состав входят локусы rol генов A, B, C и D, локализованные в Tj^-обла-сти. Встраивание этих локусов pRi Т-ДНК в ядерный геном растительной клетки приводит к увеличению чувствительности ее ауксиновых рецеп-торных белков, что существенно изменяет гормональный статус клетки и обеспечивает ее независимость от экзогенно вводимых ростовых веществ. Результатом изменения гормонального состояния растительной клетки и является проявление ее неопластического роста в месте поранения и инфицирования растения почвенной бактерией.
Копирование в лабораторных условиях давно известного явления естественно происходящей в природе трансформации растений pRi Т-ДНК привело к появлению в середине 80-х годов прошлого столетия метода культивирования генетически модифицированных корней растений, который моментально был взят на вооружение многочисленными исследователями в лабораториях различных стран. В течение прошедших 25 лет со времени первых публикаций с использованием метода генетически трансформированных корней были введены в культуру in vitro корни более 140 видов растений, относящихся к 40 семействам. По результатам этих работ опубликован ряд ценных статей и обзоров, в которых можно найти разделы, посвященные истории появления метода [1], механизму интеграции pRi Т-ДНК в растительный геном [2], различным направлениям исследований с его использованием [3—5], а также перспективам его практического применения [6, 7]. Наиболее полная информация по этим основным разделам представлена в сборнике под редакцией Doran [8].
Несколько слов о терминологии, которая применяется в русскоязычных публикациях, относящихся к использованию данного метода. Произвольный перевод понятия "hairy root disease", которое было взято за основу термина "hairy root culture" в англоязычной литературе, в отечествен-
ной печати привел к использованию таких выражений как "культура косматого" или "культура бородатого корня", хотя правильнее было бы говорить о "культуре волосатого корня". На самом деле корни, введенные в культуру in vitro в результате использования метода генетической трансформации с помощью pRi Т-ДНК, теряют свой первоначальный "космато-бородатый" вид, характерный для проявления заболевания, называемого "hairy root disease". Они выглядят как обычные быстро растущие первичные корни растений и отличаются от них только нарушенным апикальным доминированием, которое обусловливает их интенсивное ветвление. В дальнейшем в данном разделе будет использовано более точное определение этого метода, а именно "культура pRi Т-ДНК трансформированных корней" или "культура генетически трансформированных корней".
Характерной морфологической особенностью введенных в культуру генетически трансформированных корней, помимо их быстрого роста на питательных средах без гормонов, является утрата геотропической ориентации корней и проявление у них плагиотропного роста. Параллельно с этим корни сохраняют в условиях in vitro генетическую стабильность и способность к синтезу корнеспецифичных для данного растения вторичных метаболитов, что кардинально отличает их от культуры не дифференцированно растущих клеток и тканей. Биохимическим (маркерным) признаком культуры pRi трансформированных корней служит их способность к образованию опинов — маннопина или агропина, что обусловлено встраиванием в ядерный геном растения определенных фрагментов, расположенных в TR-области плазмидной Т-ДНК почвенной бактерии, обеспечивающей таким образом поддержание условий для своего питания.
Следует отметить, что вирулентность почвенной бактерии не проявляется в природных условиях у однодольных растений, а также у ряда двудольных растений, относящихся к некоторым семействам (например, Brassicaceae, Papaveraceae). В связи с этим, для проведения в лабораторных условиях генетической трансформации растений, устойчивых к A. rhizogenes, следует использовать иные, более сложные способы введения pRi Т-ДНК в растительные клетки, информация о которых в данной статье отсутствует.
Для проведения генетической трансформации растений и последующего получения аксенично растущей культуры корней используют чаще всего стерильно выращенные в пробирках проростки растений. Сложнее проводить трансформацию с нестерильными растениями, так как предваритель-
ная обработка частей растений стерилизующими агентами не всегда бывает удачной, что может вызвать или проявление нежелательной инфекции (контаминации), или повреждение растительных эксплантов в результате их стерилизации. Исключение составляют запасающие органы растений (например, корнеплоды моркови, свеклы), которые переносят достаточно жесткие условия предварительной стерилизации, после чего их нарезают на сегменты, удаляя предварительно поверхностную часть мясистого корнеплода, находившуюся в непосредственном контакте со стерилизующим агентом. Наиболее удобными частями целых ювенильных растений для проведения трансформации являются семядоли и ги-покотили проростков. Листовые пластинки первых настоящих листьев используются в том случае, если они имеют выраженное жилкование. Часто для проведения трансформации используются черешки листьев. Подготовку р
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Пoхожие научные работы по теме «Биология»
ВДОВИТЧЕНКО М.Ю., КУЗОВКИНА И.Н., ПЭТЦ Х., ШНАЙДЕР Б. — 2007 г.

Фадеев Антон Сергеевич Инфекционист-паразитолог Об авторе
Первый вид ризобий (Rhizobium leguminosarum) был идентифицирован в 1889 году, и все последующие виды были отнесены к роду Rhizobium. Однако, более поздние методы анализа заставили пересмотрели эту классификацию и сейчас многие из этих бактерий отнесены к другим родам. Срок Rhizobium все еще иногда используется как единственное от срока клубеньковые бактерии (rhizobia).
Наибольшее количество исследований сделана на видах, симбиотических с культурными представителями семейства бобовые (например, клевер, бобы и соя). Однако, в последнее время некоторые данные были получены также для диких видов бобовых.
Что же делать в такой ситуации ? Для начала советуем почитать эту статью. В данной статье подробно описываются методы борьбы с паразитами. Также рекомендуем обратиться к специалисту. Читать статью >>>
Клубеньковые бактерии не могут независимо фиксировать азот и требуют для этого растение-хозяина.
Что такое клубеньковые бактерии
Больше 2 тыс. лет назад земледельцы заметили, что бедные, выработавшие ресурс почвы дают урожаи после возделывания на них бобовых культур. Следующие попытки раскрыть секрет были в 1838 г.: Ж.-Б. Буссенго решил, что листья бобовых фиксируют азот, однако опыты с неблагоприятной водной средой не подтвердили это. В 1901 г. была открыта Azotobacter chroococcum (6 видов из рода азотобактер). Первый препарат на основе «земляных» бактерий Нитрагин был создан в 1897-м.
Rhizobium (от греческих слов riza — корень и bios — жизнь) — гетерогенная группа азотфиксирующих бактерий, живущих в почве, в корневых узелках растений семейства бобовых в симбиозе с ними.
Все клубеньковые бактерии – это микроаэрофилы. Им свойственна палочковидная/овальная форма. Относятся Rhizobium (Rhizobiales) к способным переводить газообразную форму азота в усвояемую растениями – растворимую. Факты:
- По тому, насколько влияют микроорганизмы на урожай, их разделяют на активные (эффективно обогащают почву), малоактивные и неактивные (неэффективные).
- Когда нет влаги, они не размножаются, поэтому при засушливом климате специально зараженные растения вводят в почву глубже.
- Оптимальная температура для размножения всех представителей азотфиксирующих – 20-30°С, но рост продолжается и при 0-35°С. Лучшая среда (pH) – нейтральная, порядка 6,5-7,1, а вот кислая вызывает гибель колоний.
- Благодаря опытам Московской сельхозакадемии выяснилось, что даже при условии отсутствия «доноров» бактериальный материал не покидает почву до 50 лет.
- Микроорганизмы способны пережить даже условия после атомного взрыва, выдержать гамма-излучение и ультрафиолет, солнечную радиацию, но не могут обитать при высокой температуре.
- Максимальное значение микроорганизмы имеют для развития корня.
Благоприятные условия и жизнь бактерий внутри клубенька
Клубеньковые бактерии демонстрируют различную эффективность фиксации азота в зависимости от условий, в которых живут и размножаются. Это кислотность почвы, ее влажность, а также наличие органических веществ (углеводов), калия, фосфора. Сравнительно недавно было обнаружено положительное влияние на клубеньковые бактерии молибдена. Его препараты вместе с известкованием приводят к существенному повышению количества белка в зернах бобовых растений. Действие бора и молибдена связано с тем, что они принимают участие в работе ферментов-дегидрогеназ.
Существуют клубеньковые бактерии с различной эффективностью азотфиксации. Чувствительность к условиям обитания во многом зависит от растений-хозяев и их требований к качеству почв. Так, клубеньковые микроорганизмы клевера более устойчивы к повышенной кислотности почв, чем их сородичи, сотрудничающие с люцерной.
Оптимальной температурой для этих микроорганизмов является 24-26°С. Их препараты способны храниться в неактивном состоянии при температуре от –2 до –4°С.
Их появление в клетках корней начинается с проникновения сквозь корневые волоски. Сначала образуется тяж внутри волоска, затем бактерии проникают внутрь корней растений, стимулируя их разрастание и образование клубеньков. Согласно современным данным, клубеньковые бактерии способны жить только в полиплоидных (несущих увеличенное количество хромосомных наборов) клетках корней растений.
Роль клубеньковых бактерий в природе
Помимо фиксации атмосферного азота роль клубеньковых бактерий в природе очень велика. В процессе размножения они «занимаются» синтезом витаминов, природных антибиотиков, способствуют развитию сначала корня, а затем и ботвы. Польза заключается в том, что почвенные бактерии азотфиксирующего типа за счет симбиоза с растениями:
- являются частью круговорота вещества – азота;
- синтезируют фитогормоны, стимулируя рост растений;
- могут использоваться как способ самоочищения загрязненных тяжелыми металлами почв при минерализующих факторах (природных/предприятиях);
- разлагают некоторые хлорсодержащие соединения.
Функции клубеньковых бактерий
Учеными установлен целый список функций, которые выполняются этими микроорганизмами:
- ассимиляция различных углеводных соединений;
- ассимиляция органических кислот;
- ассимиляция многоатомных спиртов;
- ассимиляция молекулярного азота в симбиозе с растениями;
- повышение урожайности бобовых;
- выделение веществ, способствующих активизации разрастания корневой системы;
- повышение показателя плодородия почвы.
В этом видео рассказано о клубеньковых бактериях.
Активность выполнения перечисленных функций зависит от ряда причин, среди которых выделяют:
- температурные показатели окружающей среды – при повышенных температурах они прекращают свою активную жизнедеятельность;
- освещения;
- кислотно-щелочного баланса почвы;
- наличия достаточного количества кислорода;
- наличия в земле большого количества питательных микроэлементов.
Фиксация прокариотами атмосферного азота зависит от влияния внешних условий. Например, при большом содержании в почве азотнокислых и аммиачных солей, скорость азотной фиксации угасает, а при их дефиците, наоборот, увеличивается. Это обусловлено тем, что находящиеся в растении и почве азотистые соединения блокируют притяжение их новых «порций» из атмосферы. Также на эту способность оказывает влияние и молибден: при его добавлении в почву процесс азотного притяжения активизируется. Это объясняется тем, что молибден является составляющей ферментов, которые осуществляют фиксацию атмосферного азота.
Бобовые растения и клубеньковые бактерии
Как взаимодействуют бобовые растения и клубеньковые бактерии? После заражения растения продуценты усваивают азот из воздуха, преобразуя его в соединение, пригодное для питания не только паразита, но и для «хозяина». Есть несколько теорий о том, как отдельные элементы образуют бактериальные клубеньки. Происходит заражение растений:
- через повреждение тканей;
- проникновением через корневые волоски;
- внедрением через молодые верхушки корня;
- благодаря бактериям-спутницам.
Симбиотические бактерии рода Ризобиум, проникнув в корень, перемещаются в его ткани, легко преодолевая межклеточное пространство группами или одиночными клетками (как у люпина). Чаще же клетка при размножении образовывают инфекционные нити (тяжи, колонии). Их количество различается по типам растений. Часто встречаются общие нити заражения, формирующие один клубенек.
Фиксация азота бактериями
Ценность, которую представляет фиксация азота бактериями, огромна: это не только восстанавливает почву, но и позволяет получать более богатые урожаи, чем на перегное или химических удобрениях. Происходит взаимодействие вещества и азотфиксатора:
- у Azotobacter («автономных», не требующих наличия растения) – ферментами, за счет кислорода в клетке;
- у Rhizobium (клубеньковые бактерии) – только в присутствии магния, серы, железа.
Азотфиксирующие растения
По растениям группируются виды, на которые подразделяются азотфиксирующие бактерии. В сельском хозяйстве учитывают, что бобовые – не единственные «хозяева» природных удобрений, помогающих усваивать атмосферный азот. Существует несколько растений, корневища которых являются благоприятной средой для обитания таких микроорганизмов. К ним относятся:
- представители семейства бобовых;
- люцерна;
- донник;
- клевер;
- гороха;
- чин;
- кормовые бобы;
- соя;
- люпин;
- сераделла;
- фасоль;
- арахис;
- вигна;
- коровий горох;
- ольха;
- лесной вейник.
Интересно, что эти микроорганизмы полиморфны, то есть их форма может быть абсолютно разнообразной: от овальной до нитевидной. Также они могут быть подвижными, а могут и утрачивать эту способность. В основном молодые представители характеризуются формой палочки, которая со временем деформируется. Такие изменения обуславливаются накоплением большого количества питательных веществ.
Клубеньковые бактерии: примеры пользы
Этот вид бактериальных форм способен скапливать азот, что очень важно не только для самого растения, но и для сельского хозяйства в целом. Симбиоз посадки и прокариот значительно увеличивает урожайность. Также многие фермеры и дачники дополнительно подкармливают посадки, изготавливая из бактериальных форм, формирующих клубеньки, удобрения. Оно используется для обрабатывания семян бобовых культур. Такая обработка позволяет активизировать процесс дальнейшего инфицирования корневищ.
Еще один пример пользы таких прокариот – участие в круговороте азотистых соединений в природе. Такой вывод обуславливается тем, что по статистике, на 1 гектар высаженных бобовых, достигших плодоносящего периода и вступивших в симбиоз с прокариотами такого типа, связывает в среднем 100-400 килограмм азота.
В процессе своего размножения они синтезирую витамины, антибиотические вещества природного происхождения, что способствует ускоренному развитию корневой системы. Также они ускоряют рост посадки, синтезируя фитогормоны.
Питание клубеньковых бактерий
Эти бактериальные формы питаются соединениями, которые вырабатываются флорой взамен на то, что они улавливают азот из воздуха и формируют его в форму, пригодную для поглощения растительными культурами. Так, из корневой системы они добывают углеводные соединения. Помимо углеводов, они могут поглощать сахара, аминокислоты и иные вещества, которые выделяются корневой системой.
Благодаря такому сожительству вокруг корневой системы формируется ризосфера – слой почвы, который насыщен полезными и питательными веществами, переработанными из отмерших участков флоры. Такие полезные вещества доступны для питания растительных культур и самих бактериальных клеток, что подтверждает факт взаимополезного бактериально-растительного симбиоза.
Победить паразитов можно!
Антипаразитарный комплекс® - Надежное и безопасное избавление от паразитов за 21 день!
- В состав входят только природные компоненты;
- Не вызывает побочных эффектов;
- Абсолютно безопасен;
- Защищает от паразитов печень, сердце, легкие, желудок, кожу;
- Выводит из организма продукты жизнедеятельности паразитов.
- Эффективно уничтожает большую часть видов гельминтов за 21 день.
Сейчас действует льготная программа на бесплатную упаковку. Читать мнение экспертов.

Мезофилы у животных и растений, температура размножения

Грибы паразиты растений: представители, жизненный цикл развития

Значение паразитов в природе: роль паразитических червей, грибов и бактерий

Бактерии симбионты человека, животных и растений: примеры, питание, значение

Сенная палочка: описание бактерии, питание, значение для человека и растений

Грибы паразиты злаковых растений: представители, жизненный цикл
Список литературы
- Centers for Disease Controland Prevention. Brucellosis. Parasites. Ссылка
- Corbel M. J. Parasitic diseases // World Health Organization. Ссылка
- Young E. J. Best matches for intestinal parasites // Clinical Infectious Diseases. — 1995. Vol. 21. — P. 283-290. Ссылка
- Ющук Н.Д., Венгеров Ю. А. Инфекционные болезни: учебник. — 2-е издание. — М.: Медицина, 2003. — 544 с.
- Распространенность паразитарных болезней среди населения, 2009 / Коколова Л. М., Решетников А. Д., Платонов Т. А., Верховцева Л. А.
- Гельминты домашних плотоядных Воронежской области, 2011 / Никулин П. И., Ромашов Б. В.

Лучшие истории наших читателей
Тема: Во всех бедах виноваты паразиты!
От кого: Людмила С. ([email protected])
Кому: Администрации Noparasites.ru
Не так давно мое состояние здоровья ухудшилось. Начала чувствовать постоянную усталость, появились головные боли, лень и какая-то бесконечная апатия. С ЖКТ тоже появились проблемы: вздутие, понос, боли и неприятный запах изо рта.
Думала, что это из-за тяжелой работы и надеялась, что само все пройдет. Но с каждым днем мне становилось все хуже. Врачи тоже ничего толком сказать не могли. Вроде как все в норме, но я-то чувствую, что мой организм не здоров.
Решила обратиться в частную клинику. Тут мне посоветовали на ряду с общими анализами, сдать анализ на паразитов. Так вот в одном из анализов у меня обнаружили паразитов. По словам врачей – это были глисты, которые есть у 90% людей и заражен практически каждый, в большей или меньшей степени.
Мне назначили курс противопаразитных лекарств. Но результатов мне это не дало. Через неделю мне подруга прислала ссылку на одну статью, где какой-то врач паразитолог делился реальными советами по борьбе с паразитами. Эта статья буквально спасла мою жизнь. Я выполнила все советы, что там были и через пару дней мне стало гораздо лучше!
Улучшилось пищеварение, прошли головные боли и появилась та жизненная энергия, которой мне так не хватало. Для надежности, я еще раз сдала анализы и никаких паразитов не обнаружили!
Кто хочет почистить свой организм от паразитов, причем неважно, какие виды этих тварей в вас живут - прочитайте эту статью, уверена на 100% вам поможет! Перейти к статье>>>
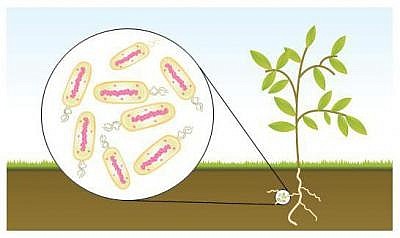
В этой статье расскажем о полезных функциях азотофиксирующих бактерий и подберем препараты на их основе.
Процессы жизнедеятельности
Все азотфиксирующие бактерии по особенностям процессов жизнедеятельности можно объединить в две группы.
- Первая группа является нитрифицирующей. Суть обмена веществ в этом случае заключается в цепочке химических превращений. Аммоний, или аммиак, превращается в нитриты - соли азотной кислоты. Нитриты, в свою очередь, превращаются в нитраты, тоже являющиеся солями этого соединения. В виде нитратов азот лучше усваивается корневой системой растений.
- Вторая группа называется денитрификаторами. Они осуществляют обратный процесс: нитраты, содержащиеся в почве, превращают в газообразный азот.

Таким образом происходит круговорот азота в природе. К процессам жизнедеятельности также относят и процесс размножения. Происходит он путем деления клеток надвое. Гораздо реже - путем почкования. Характерен для бактерий и половой процесс, который называется конъюгация. При этом происходит обмен генетической информацией. Поскольку корневая система выделяет много ценных веществ, бактерий на ней поселяется очень много. Они преобразуют растительные остатки в вещества, которые способны впитать растения. В результате слой почвы вокруг приобретает определенные свойства. Его называют ризосферой.
Азотфиксирующие бактерии
Среди процессов, от которых зависит биологическая продуктивность на земном шаре, одним из важнейших является фиксация микроорганизмами азота атмосферы. Проблема биологической азотфиксации относится к числу основных проблем сельскохозяйственной и биологической науки. Перед учеными стоит задача изыскать возможности управления процессом азотфиксации и на этой основе увеличить урожайность сельскохозяйственных культур.
Биологический азот может служить существенным дополнением азотного фонда почвы, способствуя повышению ее плодородия и обеспечивая тем самым более экономное расходование технического азота — азота удобрений.
В земной коре общее содержание азота (молекулярного и в виде соединений) достигает 0,04% (по массе). Основная масса азота на Земле находится в атмосферном воздухе; 78% воздуха — чистый молекулярный азот. В количественном выражении это составляет 4*1015 т.
Ни человек, ни животные, ни растения не могут потреблять молекулярный азот, которым изобилует воздушный океан. Столб воздуха над одним гектаром земной поверхности содержит 80 000 т азота. Если бы растения могли его усваивать, этого запаса было бы достаточно для получения 30 ц зерновых с 1 га в течение более полумиллиона лет. Однако растениям нужен азот минеральных соединений, и, «купаясь» в молекулярном азоте, они могут испытывать «азотный голод».
Содержание доступного растениям азота в почве обычно невелико. Поэтому повышение урожайности сельскохозяйственных растений связано в первую очередь с улучшением их азотного питания.
По примерным подсчетам, для сельскохозяйственной продукции земного шара требуется ежегодно около 100 —110 млн. т азота. С минеральными удобрениями вносится лишь около 30% азота.
Дефицит азота в значительной степени компенсируется биологическим путем, в основном за счет запаса азота, аккумулированного в почве микроорганизмами, в первую очередь азотфиксирующими.
К 2000 г. на Земле будет вырабатываться в год примерно 100 млн.т азотных удобрений. Следует думать, что урожаи к этому времени удвоятся и будут выносить из почвы до 200 млн. т азота. Следовательно, и тогда роль микробиологического фактора в азотном обеспечении сельскохозяйственных растений останется весьма значительной. 
Химическая промышленность СССР по выработке минеральных удобрений находится на одном из первых мест в мире. Однако огромная территория сельскохозяйственного использования не позволяет в достаточной мере обеспечить все культуры элементами минерального питания, в том числе и азотом. Поэтому в соответствующих количествах он дается лишь для технических культур.
В СССР при существующих урожаях за год сельскохозяйственная продукция выносит из почвы около 10 млн. т азота. В то же время применение минеральных азотных удобрений у нас не превышает пока 4 млн. т, а органические дают около 2,5 млн. т азота. Так как минеральные удобрения используются растениями далеко не полностью (на 60—70%), то ежегодный дефицит возврата азота составляет не менее 4—5 млн. т.
В ближайшие годы химическая промышленность существенно увеличит выпуск минеральных удобрений. В 1975 г. продукция азотных туков должна возрасти вдвое и зерновые культуры будут получать больше азота в форме минеральных соединений. Это позволит повысить средний урожай примерно до 20 ц/га. Однако и тогда минеральные и органические удобрения не будут компенсировать выноса азота из почвы.
Признавая, таким образом, несомненную необходимость химизации земледлия, нельзя забывать о возможности и целесообразности самого широкого использования биологического азота. Это связано и с улучшением кормовой базы, так как симбиотические азотфиксаторы обеспечивают животноводство дешевым белковым кормом (люцерна, клевер и другие виды бобовых культур).
Выдающийся русский ученый, основатель советской агрохимии Д. Н. Прянишников отметил, что, как бы ни было высоко развито производство минеральных удобрений, никогда не следует забывать о целесообразности использования биологического азота.
В ряде районов черноземной зоны, где почвы возделываются уже более 300 лет, вполне удовлетворительные урожаи получают и без внесения минеральных удобрений. По расчетам же, за это время почвы должны были бы потерять весь находящийся в них азот. В том, что этого не происходит, заслуга азотфиксаторов.
Существуют две группы фиксирующих атмосферный азот микроорганизмов. Одна из них находится в симбиозе с высшими растениями, образуя клубеньки на корнях. К этой группе относятся клубеньковые бактерии. Микроорганизмы другой группы обитают в почве независимо от растений. К ним относятся азотобактер, клостридиум, бейеринкия и другие свободно-живущие микроорганизмы. Потенциальные возможности симбиотических азотфиксаторов значительно выше, чем свободноживущих.
История открытия азотфиксирующих бактерий
Проблема биологического азота возникла с развитием земледельческой культуры. Издавна из практической агрономической деятельности человека было известно, что бобовые растения повышают плодородие почвы. Еще в III — I вв. до н. э. об этом писали греческий философ Теофраст и римляне Катон, Варрон, Плиний и Вергилий.
Первое научное объяснение способности бобовых растений накапливать азот принадлежит французскому агрохимику Дж. Буссенго (1838). Он установил, что люцерна и клевер обогащают почву азотом, зерновые же и корнеплоды истощают. Эти факты он связал со способностью бобовых растений фиксировать азот из воздуха. Однако Буссенго ошибочно представлял, что агентом фиксации являются листья бобового растения. Именно это неправильное заключение через 15 лет привело Буссенго к отрицанию своего открытия.
Стремясь более веско доказать правоту своей мысли, Буссенго провел серию опытов. В отличие от проводимых им ранее экспериментов он на прокаленном песке выращивал теперь уже не проростки бобовых растений, пересаженных с поля, а тщательно промытые семена (люпин и бобы); сосуды с растениями помещались при этом под стеклянный колпак. В таких условиях обогащения растений «воздушным азотом» не произошло. Сейчас это понятно и легко объяснимо.
Именно тщательность постановки опыта, которая исключала возможность заражения корневой системы проростков клубеньковыми бактериями, привела Буссенго к результатам, опровергшим прежние его данные. Считая тем не менее последние опыты более достоверными и не предполагая даже о существовании клубеньковых бактерий, он признал результаты прежних опытов ошибочными и отрекся от них.
Понадобилось несколько десятилетий, прежде чем удалось установить, что молекулярный азот бобовые растения фиксируют только в симбиозе с микроорганизмами, вызывающими образование клубеньков на их корнях.
Огромный опыт, накопившийся к настоящему времени, свидетельствует о большой роли бобовых растений в плодородии почв. Прянишников указывает, что после введения в Европе севооборотов с посевом клевера средняя урожайность зерновых повысилась с 7 до 17 ц на 1 га. В Московской сельскохозяйственной академии им. К. А. Тимирязева урожаи ржи в шестипольном севообороте с клевером однолетнего пользования на протяжении 50 лет без внесения минеральных удобрений сохраняются на уровне 14 га на 1 га, а без клевера урожай достигает лишь 7 ц. На более плодородных почвах при хорошей агротехнической обработке бобовые растения повышают урожайность еще больше.
Поэтому не удивительно, что в странах с высокоразвитым земледелием обычно до 20— 25% окультуренной площади занято бобовыми растениями. При этом одновременно можно получить и ценный корм — зеленую массу растений, и обогащение почвы азотом.
Бобовые растения играют, по-видимому, главную роль в связывании молекулярного азота в возделываемых почвах. Однако неправильно было бы думать, что все виды бобовых растений в равной степени обогащают почву. Общее увеличение количества азота в надземной массе и пожнивных остатках при культивировании люпина составляет 150—200 кг, клевера красного — 180 кг, люцерны — 300 кг, донника — 150 кг, зерновых бобовых — 50 — 60 кг азота в год на 1 га почвы. При этом прибыль азота в почве для всех перечисленных видов, за исключением зерновых бобовых, составляет примерно 50—70 кг на 1 га.
В настоящее время известно также свыше 200 различных видов других растений, для которых способность фиксировать азот в симбиозе с микроорганизмами, образующими клубеньки на корневой системе или на их листьях, вполне доказана. Большинство из них относится к деревьям и кустарникам.
В дальнейшем список азотфиксаторов пополнился новыми видами микроорганизмов — представителей других систематических групп.
Деятельность всех свободноживущих азот-фиксирующих бактерий в почве ограничена недостатком органических веществ. Поэтому они и не могут обеспечить значительного накопления азота (в среднем они накапливают не более 5 кг азота на 1 га). Их деятельность можно активировать внесением свежего органического вещества.
Проникновение бактерий в корень
Пути проникновения бактерий в корень Существует несколько способов внедрения бактериальных клеток в ткани корневой системы. Это может произойти вследствие повреждения покровных тканей или в местах, где клетки корня молодые. Зона корневых волосков также является путем проникновения хемотрофов внутрь растения. Далее корневые волоски инфицируются и в результате активного деления бактериальных клеток образуются клубеньки. Внедрившиеся клетки образуют инфекционные нити, которые продолжают процесс проникновения в растительные ткани. С помощью проводящей системы бактериальные клубеньки связаны с корнем. С течением времени в них появляется особое вещество - легоглобин.

К моменту проявления оптимальной активности клубеньки приобретают розовую окраску (благодаря пигменту легоглобину). Фиксировать азот способны лишь те бактерии, которые содержат легоглобин.
Значение хемотрофов
Люди давно заметили, что, если перекопать бобовые растения с почвой, урожай на этом месте будет лучше. На самом деле суть не в процессе вспахивания. Такая почва больше обогащается азотом, столь необходимым для роста и развития растений. Если лист называют фабрикой по производству кислорода, то азотфиксирующие бактерии могут по праву называться фабрикой по производству нитратов. Из-за недостатка знаний их приписывали только растениям и не связывали с другими организмами. Было высказано предположение, что листья могут фиксировать атмосферный азот. В ходе экспериментов было выяснено, что бобовые, которые выросли в воде, такую способность утрачивают. Более 15 лет этот вопрос оставался загадкой. Никто не догадывался, что осуществляют все это азотфиксирующие бактерии, среда обитания которых не была изучена. Оказалось, что дело в симбиозе организмов. Только вместе бобовые и бактерии могут производить нитраты для растений. Сейчас ученые выявили более 200 растений, которые не относятся к семейству бобовых, но способны образовать симбиоз с азотфиксирующими бактериями. Картофель, сорго, пшеница также обладают ценными свойствами.
Читайте также:



