Какой белок содержится в волосах перьях рогах
Опубликовано: 17.09.2024
Тесты по химии 10 класс. Тема: "Белки"
Правильный вариант ответа отмечен знаком +
1. При гидролизе простых белков образуются:
- только фрагменты небелковой природы
- как аминокислоты, так и фрагменты небелковой структуры
2. Глобулярные белки имеют структуру:
3. Какой белок содержится в волосах, перьях, рогах и других производных кожи:
4. Первичная структура белков представлена:
+ последовательностью аминокислотных остатков
- последовательностью карбоксикислотных остатков
- последовательностью аминовых остатков
5. В молекулах инсулина человека содержится последовательность:
+ треоинин – серин – изолейцин
- аланин – серин – валин
- треонин – глицин – изолейцин
6. На данном изображении представлена:
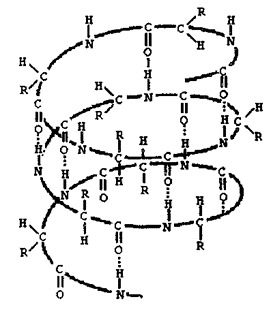
+ вторичная структура белков
- первичная структура белков
- третичная структура белков
7. Какая связь присутствует во вторичной структуре белков?
- ковалентная полярная связь
- ковалентная неполярная связь
8. Между какими структурами возникает водородная связь?
+ между кислородом и азотом
- между кислородом и водородом
- между водородом и углеродом
9. Какую форму имеет вторичная структура белка?
тест 10. Сколько аминокислотных остатков приходится на один виток спирали?
+ три целых шесть десятых
- восемь целых девять десятых
- четыре целых пять десятых
11. Какие связи образуют третичную структуру белка?
+ как ковалентные, так и водородные
12. Какие аминокислотные остатки имеются в глобулярной структуре белка?
+ как гидрофильные, так и гидрофобные
13. Примером четвертичной структуры белка является:
14. Какие ионы содержит гем в структуре гемоглобина?
15. Гемоглобин входит в состав:
16. Из скольких аминокислотных остатков состоит гемоглобин?
+ из ста сорока одного
- из ста пятидесяти шести
- из ста восьмидесяти девяти
17. Лизоцим содержится в:
18. Какую молекулярную массу имеет лизоцим?
+ четырнадцать тысяч шестьсот
- пятнадцать тысяч девятьсот
- тринадцать тысяч семьсот
19. Сколько процентов составляет коллаген в белковом веществе организмов млекопитающих?
тест-20. При денатурации сохраняется:
+ первичная структура белка
-третичная структура белка
- четвертичная структура белка
21. Восстановление пространственной структуры белка называется:
22. Свертывание белка альбумина в составе куриного белка является примером:
23. Для определения относительной молекулярной массы белка используется:
24. Скорость оседания белков зависит от:
+ относительной молекулярной массы, формы и плотности
- относительной молекулярной массы
25. В щелочных растворах белки находятся:
+ только в анионной форме
- только в катионной форме
- как в анионной, так и в катионной форме
26. Для обнаружения пептидных связей применяется:
27. Для биуретовой реакции используются компоненты:
+ растворы щелочи и соли меди
- растворы кислот и соли алюминия
- растворы щелочи и соли платинума
28. Какой цвет подтверждает наличие белка в биуретовой реакции?
29. Какую аминокислоту можно обнаружить ксантопротеиновой реакцией?
тест_30. Какой реагент используется для обнаружения определенных аминокислот в белке?
+ концентрированная азотная кислота
- неконцентрированная азотная кислота
- концентрированная серная кислота
31. Условием для гидролиза белка является:
- нет необходимости в определенных условиях
32. Какой реактив используется в реакции Сенгера?
33. Для чего применяется гидролиз белков?
+ для определения числа и природы аминокислот
- для определения относительной молекулярной массы белков
- для определения предела допустимой температуры
34. Какой метод был введен Робертом Брюсом Меррифилдом?
+ метод твердофазного синтеза пептида
- метод мягкофазного синтеза пептида
- метод трехфазного синтеза пептида
35. Гормоны в организме человека является:
36. Антибиотики пенициллинового ряда образованы:
+ валином и цистеином
- аланином и серином
- аспарагином и лизином
37. Пептиды обычно используют в качестве:
38. В каком году впервые были получены синтетические гормоны?
+ в тысяча девятьсот пятьдесят третьем году
- в тысяча восемьсот шестьдесят восьмом году
- в тысяча семьсот тридцать пятом году
39. Сколько аминокислотных остатков содержит инсулин?
тест*40. Какая болезнь возникает в результате недостатка инсулина?

Стержень волоса на 80% состоит из белка, поэтому наш рацион должен содержать достаточное его количество для обеспечения фолликула волоса этим строительным материалом.
Предпочтительными являются белки животного происхождения – они содержат незаменимые аминокислоты, не синтезируемые в организме. Мясо и рыба должны быть обязательно включены в каждодневное питание. Фрукты и овощи будут способствовать профилактике гиповитаминозов, а орехи, сухофрукты и крупы – микроэлементных нарушений. Полезны волосам и коже головы и полиненасыщенные жирные кислоты: в большом количестве они содержатся в рыбьем жире (жирные сорта рыбы – семга, палтус). Дефицит эссенциальных жирных кислот играет важную роль в развитии дерматита волосистой части головы и выпадения волос. Выпадение волос вследствие дефицитных состояний происходит со всей поверхности кожи головы (диффузное выпадение), стержень волоса может стать сухим и тонким, в некоторых случаях меняется и цвет волос, поскольку меланоциты также страдают от нехватки незаменимых жирных кислот. Дисбаланс этих нутриентов чаще всего имеет алиментарную природу и наиболее распространен среди тех, кто потребляет недостаточное количество рыбьего жира и красного мяса. Наиболее важными среди всех эссенциальных жирных кислот считаются омега-3 жирные кислоты (производные линолевой кислоты, присутствуют в красном мясе и овощах) и омега-6 жирные кислоты (производные альфа-линоленовой кислоты, присутствуют в жирной рыбе и морепродуктах). Прием омега-3 и 6 жирных кислот оказывает выраженный эффект при выпадении волос и шелушении кожи головы, возникших вследствие дефицита этих жирных кислот. С пищей необходимо потреблять также минимальное количество холестерина, который входит в состав клеточных мембран и способствует делению клеток.
Для здоровья волос также важны и основные микроэлементы – железо, селен, цинк, кальций, хром, медь, йод, марганец и кремний
Одним из главных лидеров среди микроэлементов, недостаток которых может сказаться на состоянии волос, является железо. При нехватке этого элемента волосы секутся, становятся сухими, теряют блеск и выпадают. Железодефицит в большинстве случаев наблюдается именно у женщин, ведь женщина теряет железо ежемесячно во время менструации, расходуется железо во время беременности и родов, а бесконтрольные диеты и распространенное сейчас вегетарианство способны стать причиной анемии -снижения гемоглобина в крови. Стоит отметить, что диагностировать железодефицитную анемию, и особенно скрытый железодефицит, не всегда легко – его симптомы не слишком специфичны, зачастую проверить уровень железа в организме заставляет именно выпадение волос. Источником железа являются, в основном, продукты животного происхождения – печень, красное мясо, почки. Железо, содержащееся в этих продуктах, называется “гемовым железом”, поскольку по строению напоминает железо, содержащееся в гемоглобине. Гемовое железо усваивается практически полностью. “Негемовое железо” поступает из риса, хлеба, брокколи, фасоли, шпината, всасывается оно гораздо хуже, и именно поэтому вегетарианцы входят в основную группу риска по железодефициту. Усвоение железа зависит от других компонентов рациона. Витамин С способствует абсорбции железа, а кальций (молочные продукты), отруби, чай могут уменьшить его всасывание. В группу риска по дефициту железа входят и те, кто потребляет в больших количествах кофе, чай и другие напитки с кофеином. Кофеин ухудшает всасывание железа и может способствовать появлению или усугублять имеющийся железодефицит.
Другой микроэлемент, влияющий на здоровье волос, – медь. Медь необходима для усвоения железа. Недостаток меди может косвенно способствовать диффузному выпадению волос за счет снижения всасывания железа. Недостаток этого микроэлемента в рационе питания может также непосредственно влиять и на качество волос. Волосяное волокно становится более тонким и ломким, укорачивается и стадия роста волоса
Еще один важный микроэлемент – цинк. Цинк необходим в производстве волосяного волокна, а дефицит цинка приводит к диффузному выпадению волос на голове и на теле. Вегетарианцы особенно часто имеют дефицит цинка, поскольку основной источник – мясо и рыба. Недостаток этого микроэлемента может наблюдаться и у людей, имеющих хронические заболевания желудочно-кишечного тракта. Следует обратить внимание, что хелатные соединения цинка усваиваются гораздо легче и лучше переносятся по сравнению с неорганическими его соединениями, например. сульфатом цинка.
Трихологи рекомендуют внимательно отнестись к приему витаминных комплексов
Рекомендуется профилактически принимать поливитаминные комплексы, содержащие большие дозы витаминов группы В, биотин, аминокислоты. Это поможет во многих случаях предотвратить выпадение волос или снизить его интенсивность.
К витаминам группы В относятся несколько витаминов, которые похожи по своей молекулярной структуре и деятельности. Эта группа включает в себя B1 (тиамин), В2 (рибофлавин), ниацин (никотиновая кислота), B6 (пиридоксин), В12 (цианокобаламин), фолиевую кислоту, пантотеновую кислоту, и биотин. Из них биотин, вероятно, является наиболее важным для функционирования волосяных фолликулов.
Дефицит биотина способен вызывать воспаление кожи головы, дерматит, который, в свою очередь, может вызывать хроническое выпадение волос. Было отмечено, что прием биотина в течение 2-3 месяцев способствует устранению воспаления кожи головы, устойчивого к другим методам лечения.
Тиамин и другие витамины группы В – это, прежде всего, коферменты важнейших ферментов, обеспечивающих функционирование клетки, особенно митохондрий. Митохондрии – главные внутриклеточные органеллы, производящие молекулы энергии, АТФ. Клетки волосяного фолликула имеют очень высокую степень метаболической активности. Они являются одними из наиболее активных клеток в организме. Этот исключительный уровень активности приводит к тому, что волосяные фолликулы становятся особенно чувствительны к дефициту энергии Включаются в состав комплексов и различные аминокислоты. L – цистеин – природная серо-содержащая аминокислота, структурная основа кератина, содержится в большом количестве в стержне волоса – 15,9%. Известны патологии стержня волос и виды алопеций, связанные с дефицитом L-цистеина (трихотиодистрофия, ВИЧ-ассоциированная алопеция). Еще одна очень важная аминокислота – Л-лизин, ее человек получает в основном из мясной пищи; в связи с этим у людей, не получающих достаточное количество животного белка, может наблюдаться дисбаланс этой аминокислоты. Учеными было установлено, что Л-лизин играет крайне важную роль в абсорбции железа и цинка. 1.5-2.0 г этой аминокислоты способствует более быстрому прекращению выпадения волос у лиц с железодефицитом. Следует отметить, что для достижения большего эффекта Л-лизин рекомендуется принимать вместе препаратами цинка и железа.

Однако не следует полагать, что биодобавки и поливитамины — панацея. Трихологи предпочитают не назначать полимикроэлементные препараты, так как существует определенный антагонизм между составляющими комплекс элементами. Микроэлементы предпочтительно принимать при выявлении их дефицита в организме, учитывая принципы взаимодействия микроэлементов между собой. Например, по анализам выявлен недостаток в организме цинка и переизбыток меди. Прием поливитаминов, содержащих одновременно медь и цинк, усугубит состояние: меди станет еще больше, а цинка — меньше. Если прием микроэлементных комплексов носит профилактический характер, то следует останавливать свой выбор на тех, где учтены принципы синергизма и антагонизма входящих в состав микроэлементов.
Выпадение волос может быть связано и с диетами, к которым часто прибегают женщины. Жировая ткань у женщины — не просто неэстетичная и ненужная, по мнению многих, ткань, а орган, который выполняет гормональную функцию. Если женщина теряет 10% массы тела, не страдая ожирением, а стремясь к навязанным сейчас идеалам, то это, как правило, приводит к белковому дефициту и дисбалансу минералов. Длительный алиментарный дисбаланс может способствовать возникновению острого и хронического диффузного выпадения волос: клетки волосяного фолликула имеют очень высокую скорость деления, что требует адекватного поступления к ним белка, микроэлементов, витаминов, кроме того, чувствительны фолликулы и к дефициту энергии. Выпадение волос, как правило, начинается через несколько месяцев после начала диеты и может сохраняться в течение нескольких месяцев после ее завершения.
Для того чтобы волосы получали достаточное питание, во время каждого приема пищи следует употреблять продукты, богатые витаминами, пищевыми волокнами и протеинами, минеральными веществами, углеводами и микроэлементами. Необходимо помнить, что при длительных сбоях в правильном питании волосы могут потерять свою красоту, начать выпадать, станут безжизненными и тусклыми, с секущимися концами.
Реальные достижения химиков, научившихся использовать такие продукты органического происхождения, которые до сих пор не могли быть причислены к разряду кормовых. В этом реальность, пожалуй, даже перещеголяла замыслы фантастов. Речь пойдет об использовании в корм скоту так называемых кератиновых белков, входящих, например, в состав шерсти или птичьих перьев.
И шерсть и перо почти полностью состоят из таких белков. Кератины теоретически ничем не отличаются от любых других белков живой природы, в том числе от белков пшеничного зерна, разве только упаковка белковых молекул в кератинах – в волосе или «веточке: птичьего пера – иная.
Еще в 1968 году американский ученый Ф. Шорланд обратил внимание на то, что шерсть – это более богатый источник белка, чем мясо тех домашних животных, от которых мы получаем шерсть или перо. На самом деле, если подсчитать количество белка, производимого ягнятами, овцами и козами в мире, то получится цифра, равная 0,53 миллиона тонн. А количество белка, содержащегося в шерсти этих же животных, почти в три раза больше и составляет около 1,55 миллиона тонн.
Аналогично этому домашняя птица дает 17,4 миллиона тонн мяса и в съедобной части его содержится 1,77 миллиона тонн белка, а в пере – 1,31 миллиона тонн.
Но что из этого? – скажет читатель. Подобные оценки еще ничего не говорят о возможности использования данных белков в корме. Во-первых, аминокислотный состав белков шерсти и пера может быть совершенно отличен от состава кормовых белков. Но это предположение оказалось неправильным. Когда сравнили набор аминокислот, входящих в белок шерсти мелких копытных животных, волос крупного рогатого скота, свиной щетины и птичьих перьев, с аминокислотным составом белков зерна, семян пшеницы, кукурузы, сои, бараньего мяса и, наконец, со стандартным белком, признанным за эталон пищевых белков Всемирной продовольственной и сельскохозяйственной организацией ООН (так называемый стандартный белок ФАО), то оказалось, что по набору и количеству аминокислот все эти белки довольно близки. Лишь триптофана в шерсти и перьях было заметно меньше, чем в зерновых и животных белках. В шерсти и перьях нашли также несколько меньше лизина, чем в стандартном белке ФАО, хотя в волосе крупного рогатого скота лизина оказалось больше, чем это требуется для эталонного белка. К слову сказать, в пшенице и кукурузе также не хватает лизина по сравнению с белком ФАО.
Во-вторых, весьма существенным для разбираемой проблемы оказалось и то, что аминокислотный состав белка шерсти и перьев не изменялся в сколько-нибудь сильной степени при воздействии на них сильными кислотами или щелочами. Это давало веский повод полагать, что если попытаться разложить шерсть или перо на небольшие участки белковых цепей, то есть если «переварить» химически сложные структуры кератина волоса или пера, то получатся белковые цепи с нормальными аминокислотами, вполне схожими с пищевыми белками.
В-третьих, было очень важно понять, как белки шерсти и перьев могут перевариваться ферментами слюны или желудочного сока животных. Первые данные на этот счет были получены еще в позапрошлом веке, когда В. Кюне, сотрудник Института физиологии в Гейдельберга в Германии, подверг волосы механическому размельчению, а затем обработал их пищеварительным ферментом пепсином. Кюне нашел, что увеличение поверхности волос, достигаемое после их измельчения, очень важно для реакции с пепсином. Волосы обычных размеров были совершенно нечувствительны к нему. Однако при увеличении степени размельчения волос они начинали поддаваться его действию и частично перевариваться.
Долгое время эти опыты оставались без внимания, пока в 1939 году их не продолжили Дж. Раус и Г. Льюис, опубликовавшие в «Журнале биологической химии» результаты своих экспериментов по измельчению шерсти в порошок и последующему ее перевариванию. Ученые перетирали шерсть в небольшой шаровой мельнице, а затем воздействовали на получаемый порошок пепсином и трипсином. Оказалось, что стоит перетереть шерсть до мелкодисперсного состояния, как она начинает без всякого затруднения разлагаться ферментами на свободные аминокислоты. Тем самым путь к превращению шерсти в легкоусвояемый животным организмом продукт, причем путь, не требующий больших затрат, был открыт.
Свои опыты Раус продолжал и во время войны. Естественно, что после обнаружения перевариваемости порошка из шерсти обычными пищеварительными ферментами, нужно было попытаться подержать животных на таком корме и выяснить, будет ли он усваиваться и как станут животные расти при скармливании им шерстяного порошка. Результаты таких экспериментов могли бы быть использованы для создания дешевых и полезных пищевых смесей. Раус же обнаружил в 1941-1942 годах, что не следует подвергать шерстяную муку прожариванию, так как при этом начинается частичное разрушение некоторых из аминокислот, например цистеина, аналогичное тому разрушению, каков наблюдается при пережаривании и обычной муки – пшеничной или овсяной, а в 1943 году он обнародовал уже итоги своих опытов по кормлению лабораторных животных перетертой в порошок шерстью.
Весь белок в рационах для крыс-сосунков был заменен на порошкообразную шерсть. Для этого пришлось добавлять шерстиной порошок в количестве примерно 15% от всей массы пищи. Поскольку в шерсти содержалось меньше триптофана, метионина и гистидина, чем в нормальных пищевых белках, к пище крысят добавляли небольшое количество этих аминокислот. Эксперименты свидетельствовали о значительной питательной ценности шерстяной муки. Ежедневный прирост лабораторных животных был ничуть не меньше, чем у контрольных животных, содержавшихся на обычной диете. Таким образом, главная задача, которую ставил перед собой Раус, – выяснить возможность создания абсолютно нового, дешевого и высокопитательного кормового продукта – была в принципе разрешена.
Никаких серьезных различий в кератиновых белках шерсти и аналогичных белках в таком органе, как перья, нет. И в шерсти, и в перьях содержится почти чистый белок, и, конечно, убедившись в питательности муки из шерсти, Раус продолжил работу по получению муки из перьев и испытанию ее питательной ценности. Порошок из перьев оказался столь же питательным, как и порошок, полученный из шерсти.
Этими опытами были начаты интенсивные поиски возможностей получения кормового белка из кератинов. Много сил было отдано тому, чтобы разработать методы растворения кератинов за счет химических воздействий на шерсть и перо. Благодаря этому можно было бы упростить процедуру обработки кератинов, избежать длительных операций по перетиранию шерсти и перьев. Однако первоначальные эксперименты были малоуспешными. Приходилось использовать мощные химические воздействия, так как при мягких, щадящих способах обработки кератин не поддавался распаду, а при сильных – наблюдалась порча некоторых из аминокислот, и питательная ценность получаемого продукта снижалась. Тем не менее, после целой серии опытов, проводившихся в различных лабораториях во многих странах мира, были созданы методы, позволявшие комбинировать частичное перетирание с последующей химической обработкой.
Кроме того, были сделаны попытки использовать в качестве источников кератинового белка не только шерсть и перо, но и другие близкие им по химической структуре образования, например свиную щетину, копыта мелких и крупных животных и даже рога. Все эти опыты с несомненностью показали, что и перетертая щетина, и тонко измельченные копыта и рога можно добавлять к корму животных с целью снабжения их белком. Были изучены условия такого кормления, количество необходимых добавок тех аминокислот, которых не хватает в белке шерсти, перьев, копыт или рогов, и установлено, что все перечисленные выше виды кератина способны служить хорошими источниками кормового белка.
Надо подчеркнуть, что результаты этих экспериментов, в основном нацеленные в будущее, уже вышли за рамки лабораторных исследований. Кератиновые белки все шире применяют при кормлении сельскохозяйственных животных. Так, переработанное перо с успехом добавляют к корму домашней птицы, частично заменяя им дорогостоящие белки растительного или животного происхождения. Начинают использовать кератины и в кормлении других животных.
Ведение
В клетках нашего организма помимо неорганических веществ содержатся органические вещества, которые необходимы клетке для построения ее структур и обеспечения нормальной жизнедеятельности не только отдельно взятой клетки, но и всего организма в целом.
Органические вещества, которые входят в состав живого организма, многообразны, и многие из них имеют очень сложное молекулярное строение.
Каждое сложное органическое вещество построено из повторяющихся единиц- мономеров.
Если мономеров в веществе большое количество, то такое вещество называют полимер ( от греч. "поли»- много, «мерос»- часть).
Если полимеры встречаются в природе в естественном виде, то есть входят в состав живых организмов, их называют биополимерами.
Количество мономеров в молекуле полимера может исчисляться от нескольких штук до десятков миллионов.
К примеру, молекула ДНК бактерий построена более чем из 3 млн мономеров (нуклеотидов).
Основные и наиболее важные группы органических веществ клетки:
- белки
- жиры
- углеводы
- нуклеиновые кислоты
Сегодня мы рассмотрим эти группы органических веществ, узнаем их строение и значение для организма.
Белки
Белки- это биополимеры, мономерами которых являются аминокислоты.
Аминокислоты содержат в своём составе карбоксильную (-СООН) и аминогруппу (-NH2)
Молекулы белка могут содержать сотни и даже тысячи аминокислотных остатков.
А если молекула содержит до 100 аминокислотных остатков, то принято называть эту молекулу пептидом.
Вот более точное определение: белки и пептиды - это соединения, построенные из остатков аминокислот (АК), соединенных пептидной (амидной) связью -С(О)-NH-
Также в состав белков входят углерод, водород, кислород и азот, сера.
Белок характеризуется определенной последовательностью аминокислот. Благодаря этой последовательности формируется химическая формула белка, то есть его структура.
Кроме определенной последовательности аминокислотных остатков, очень важна и трехмерная структура белка, которая формируется в результате сворачивания цепочки из аминокислот.
Аминокислотные остатки в белке связаны пептидной связью:

Выделяют четыре структуры белка:
Структуры белка
Строение
Типы химических взаимодействий(связи)
Примеры белков и графическое изображение
Первичная структура
(линейная)
Последовательность аминокислотных остатков в полипептидной цепи
Альбумин, яичный белок, состоит из аминокислот. Мономеры связаны пептидными связями, молекула образует первичную, вторичную и третичную структуры
![]()
Скручивание в спираль первичной структуры белка, стабилизировано водородными связями и гидрофобными взаимодействиями
Водородные между пептидными группами (C=O…H–N) и гидрофобные связи
Альбумин- вареный яичный белок, кератин (в сухожилиях человека), коллаген (в волосах, ногтях)

Упаковка вторичной спирали в клубок- глобулу (в виде шарика), также встречается фибриллярная структура (в виде волокон)
Ковалентные связи, ионные (электростатические) взаимодействия (между противоположно заряженными аминокислотными остатками);

Объединение нескольких глобул в сложный комплекс

Фибриллярные и глобулярные белки:
Фибриллярные белки
Глобулярные белки
Представляет собой длинные, узкие закрученные нити
Имеет округлую, сферическую форму
Отчасти растворимы (образуют коллоидные растворы)
Коллаген (кожа, кости, зубы, сухожилия), кератин (волосы, ногти)
Гемоглобин (в эритроцитах), инсулин (гормон поджелудочной железы), каталаза (обеспечивает распад пероксида водорода в живых клетках)
Структура и функции
Коллаген существует в виде тройной спирали, механически стойкой и прочной.
Много в сухожилиях, связках, соединительной ткани, мышцах, коже и других тканях, испытывающих на себе сильное механическое воздействие, выполняют структурную и сократительную функцию
Выполняют различные функции в клетках.
У меня есть дополнительная информация к этой части урока!

Гемоглобин- белок содержащийся в кровяных клетках, эритроцитах, который переносит кислород и углекислый газ, обладает четвертичной структурой.
В связывании кислорода принимает участие непосредственно ион железа, который содержится в молекуле гемоглобина.
Оксид углерода СО (угарный газ) связывается с железом в сотни раз прочнее кислорода, поэтому угарный газ смертельно опасен для человека, поскольку лишает гемоглобин возможности присоединять кислород
Денатурация и ренатурация белков
Белки могут быть активны в организме и выполнять свою функцию только при определенных физических показателях.
Например, при повышении или понижении температуры, радиации, воздействии кислот естественная структура белка может нарушаться, что, в свою очередь, может привести к гибели всей клетки.
Процесс разрушения характерной для данного белка естественной структуры (вторичной, третичной, четвертичной), носит название денатурация.
Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка.
Как правило, при этом первичная структура белка не разрушается.
Пример денатурации является свертывание яичного белка при его варке.
Денатурация бывает обратимой и необратимой.
При варке яйца происходит необратимая денатурация, так как исходную структуру восстановить уже практически невозможно и происходит разрыв большого количества связей.
Обратимая денатурация происходит если возможно восстановление свойственной белку структуры.
Если белок подвергся обратимой денатурации, то при восстановлении нормальных условий среды он способен полностью восстановить свою структуру и, соответственно, свои свойства и функции.
Процесс восстановления структуры белка после денатурации называется ренатурацией.
Функции белков в организме связаны с пространственной структурой белка и зависят от последовательности аминокислот в белке.
Основные функции белков:
- Каталитическая (ферментативная): увеличение скорости химических реакций в клетке и организме, достигается за счет функционирования биологических катализаторов, ферментов, специализированных белков, которые обеспечивают нормальное протекание обмена веществ. Ферменты эффективны, так как способны ускорять химические реакции в 106-108 раз; специфичны, регулируются различными химическими соединениями клетки
- Структурная функция: из структурных белков формируется части цитоскелета клетки, структурные белки входят в состав волос, когтей, рогов и копыт млекопитающих, компонент костной ткани. Примеры структурных белков: кератин, коллаген
- Двигательная функция: актин и миозин белковые нити, которые могут изменять форму клеток, входят в состав сократимых мышечных волокон
- Транспортная функция: белки мембран, осуществляющие активный перенос веществ из окружающей среды в клетку и обратно; белки крови, которые связывают и переносят различные вещества (например, гемоглобин, осуществляющий перенос кислорода из легких в ткани)
- Защитная функция: при попадании вирусов бактерий, чужеродных белков в организм животных, человека происходит образование белков, которые называют антителами. Антитела связываются с чужеродными веществами, которые называют антигенами. Выделение токсинов (ядовитых веществ белковой природы) живыми существами (змеи, амфибии, беспозвоночные) для обеспечения защиты и нападения. Белки крови: протромбин, тромбин, фибрин, фибриноген участвуют в свёртывании крови, тем самым прекращая кровотечение
- Регуляторная функция: регуляция активности ферментов, которые также активируют или подавляют активность других белков. Гормоны способны в очень малых концентрациях обеспечивать регуляцию метаболизма. Наиболее известным из белковых гормонов является инсулин- гормон, вырабатываемый в поджелудочной железе и регулирующий уровень глюкозы в клетках организма. При недостатке инсулина в организме возникает заболевание сахарный диабет
- Энергетическая функция: белки источник незаменимых аминокислот, при их расщеплении образуется энергия, которая необходима клетке
- Запасающая функция: запас питательных веществ в виде белковых веществ в семенах (алейроновые зерна, от греческого "мука"), в яйцах животных (овальбумин)
- Сигнальная функция белков: способность белков служить сигнальными веществами, передавая сигналы между тканями, клетками или организмами
Пройти тест и получить оценку можно после входа или регистрации
Липиды (жиры)
Липиды- сборная группа биологических соединений, полностью или почти полностью нерастворимых в воде, но растворимых в органических растворителях и друг в друге.

Таким образом, липиды - это гидрофобные соединения, то есть их молекулы по своим свойствам «стремятся» избежать контакта с водой.
Липиды широко распространены в природе и являются обязательным компонентом каждой живой клетки и ее мембран.
Липиды в клетке образуются на гладкой эндоплазматической мембране.
Они образуют энергетический резерв организма и участвуют в передаче нервного импульса, в создании водоотталкивающих и термоизоляционных покровов и др.
Многие липиды - продукты питания, используются в промышленности и медицине.
- Простые липиды (жиры, воска)- сложные эфиры жирных кислот и спиртов. Жиры- эфиры глицерина и высших жирных кислот. Воска- эфиры высших спиртов и высших жирных кислот. Воска образуют защитную смазку на коже, шерсти и перьях, покрывают листья и плоды высших растений, а также кутикулу наружного скелета у многих насекомых. Эти вещества очень гидрофобны. Пчелы используют воск для постройки сот, которые непроницаемы для воды, в сотах хранят запасы пищи и выводят потомство
- Сложные липиды состоят из глицерина, жирных кислот и других компонентов. К этой группе относятся: фосфолипиды (производные ортофосфорной кислоты, входят в состав всех клеточных мембран); гликолипиды (содержат остатки сахаров, их много в нервной ткани); липопротеиды (комплексы липидов с белками). Стероиды- небольшие гидрофобные молекулы, являющиеся производными холестерина. К ним относятся многие важные гормоны (половые гормоны и гормоны коркового слоя надпочечников), также эфирные масла, от которых зависит запах растений. Основу биологических мембран составляют фосфолипиды. Гидрофильная часть (головки) липида взаимодействует с водой, а гидрофобные (хвостики) части «прячутся» от воды.

- структурная: формирование биологических мембран
- энергетическая: при окислении жиров до углекислого газа и воды выделяется большое количество энергии (38,9 кДж/г)
- запасающая: накопление жиров в клетках и органах живых организмов
В растениях жиры накапливаются главным образом в плодах и семенах, у животных - в подкожных жировых тканях, окружающих внутренние органы, а также печени, мозговой и нервной тканях
- регуляторная: обеспечивается за счет действия гормонов
- образование воды: при окислении жира образуется вода (при сжигании 1 г жира образуется 1,1 г воды); используется животными пустынь (верблюды) или впадающими в зимнюю спячку (сурки, суслики) для нужд метаболизма, поэтому эти животные могут длительное время обходиться без воды, используя свои жировые запасы
- теплоизоляционная: у животных жиры откладываются в подкожной клетчатке, где создают хороший теплоизоляционный слой, особенно развитый у морских млекопитающих: китообразных и ластоногих
- защитная: жировая подушка вокруг внутренних органов защищает от механических повреждений при движении, прыжках, ударах; у растений воск создает защитный налет на листьях и плодах
У меня есть дополнительная информация к этой части урока!

Особое место среди липидов занимают стероиды: полициклический спирт холестерол (чаще называемый холестерин) и его производные.
Холестерин и его эфиры с жирными кислотами входят в состав биологических мембран клеток животных, придавая им определенную «жесткость».
У растений и грибов холестерин не встречается, его место у растений занимает стероид стигмастерол, а у грибов- эргостерол.
У животных из холестерина образуются гормоны
Пройти тест и получить оценку можно после входа или регистрации
Белки — это строительные материалы и живые нано-машины нашего тела. По сравнению с липидами и углеводами белки являются наиболее важными для организма.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин), жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.

Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─ 
) с основными свойствами, другая —карбоксильной группой (─COOH) с кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется (полимеризацией). В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И, кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Среди белков различают протеины, состоящие только из белков, и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем.
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии. В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют «гликопротеиды». Если входят липиды — то «липопротеиды», а если нуклеиновые кислоты — «нуклеопротеиды».
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.

Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции — образование осадка. Белок денатурирован.
Денатурация белка происходит и под действием растворов солей тяжёлых металлов. К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы —конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется — первичной структурой белковой молекулы. Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой — это вторичная структура. Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, — вторичная структура белка достаточно прочна. Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка. Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Структурная функция белков
Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев. Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности. Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку.
Связывание субстрата осуществляется именно в активном центре фермента. Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества — субстрата.
Многие ферменты, как мы уже сказали, представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.

Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител. Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Ещё один важный белок нашего организма — интерферон — универсальный противовирусный белок.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
Регуляторная функция белков присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является упомянутый выше инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии.
Но в качестве источника энергии белки используются в последнюю очередь, после углеводов и жиров. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Таким образом, роль белков огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счёте набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Читайте также:

