Как сделать микропрепарат волоса
Опубликовано: 17.09.2024
Домашняя микроскопия подразумевает покупку готовых наборов микропрепаратов, что можно найти в разделе аксессуаров, а также в комплекте с микроскопами, среди которых начинающим больше всего подойдут варианты марки Микромед, Levenhuk. Но интереснее наблюдать и изучать то, что уже есть у нас под рукой в частном доме, в квартире и во дворе. Исследование того, что нас ежедневно окружает, дарит поистине яркие впечатления. Поэтому позаботьтесь о доступных средствах наблюдения и об объектах.
Что обычно исследует домашняя микроскопия?
Самые простые варианты:
- растения – листья, стебли, корни;
- овощи, фрукты, ягоды;
- насекомые;
- микроорганизмы;
- кристаллы.
Растения и их плоды
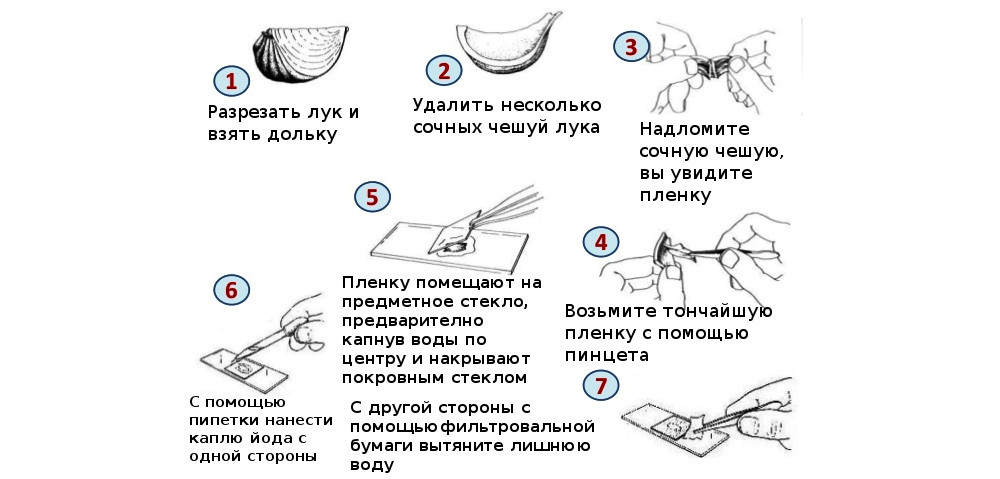
В домашних условиях можно начать изучение микромира с обычного репчатого лука, точнее с его кожуры. Ее структура тонкая и хорошо проглядывается даже под детским микроскопом. Но кожицу надо заранее подкрасить йодом. Иногда можно обойтись и зеленкой. Рекомендуем при этом использовать специальные бюксы либо часовые стекла.
Исследование лука
- Приготовьте микроскоп, настройте свет. Протрите предметное и покровное стекла салфеткой. Капните слабый раствор йода и воды на предметное стекло.
- Разрежьте луковицу, снимите чешую. С мясистой части луковицы сорвите кусочек пленки пинцетом и положите его в созданную каплю на стекле.
- Расправьте приготовленную кожицу на стекле.
- Накройте препарат покровным стеклом.
- Ваш временный препарат готов!
- Наблюдайте препарат под увеличением 64x (объектив х4, окуляр х16). Двигайте предметное стекло, пока не найдете подходящее место, где лучше всего различимы продолговатые клетки.
- Увеличьте кратность до 400 раз (объектив 40x, окуляр 10x).
Большое увеличение позволяет рассмотреть плотную прозрачную оболочку с более тонкими участками – порами. Внутри клетки находится бесцветное вязкое вещество – цитоплазма, окрашенная йодом. В цитоплазме Вы заметите небольшое плотное ядро, где находится ядрышко. В большинстве клеток, особенно в старых, хорошо различимы полости – вакуоли.
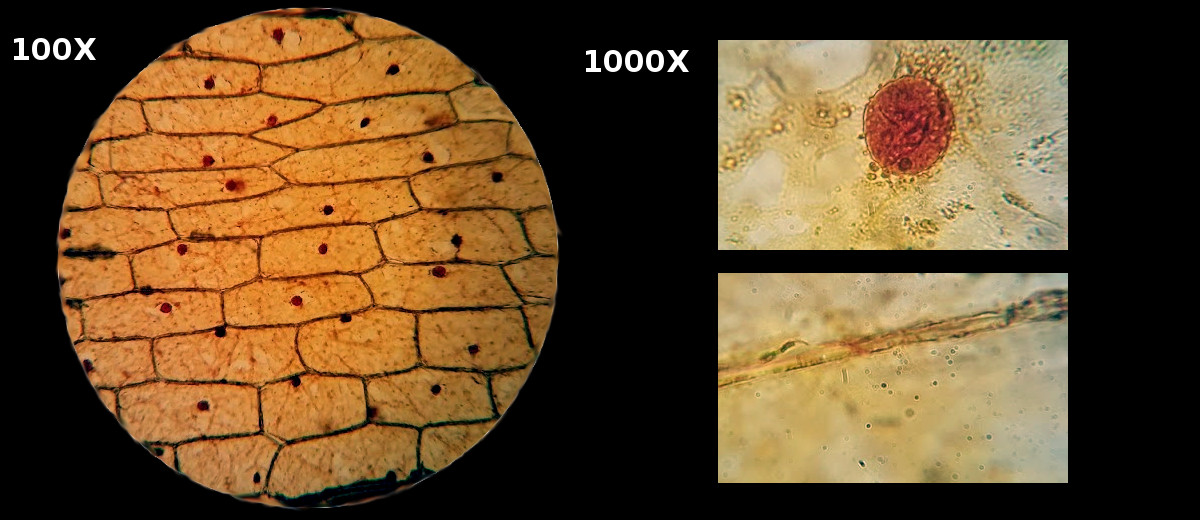
Рис. Фотографии получены с помощью микроскопа Микромед Р-1
Под биологическим микроскопом Вы увидите в строении кожуры чётко различимые ядра клеток. Конечно, большинство взрослых такой эксперимент уже проводили в школе, но самым юным исследователям такой анализ растения будет в новинку.
Кожура фруктов и ягод тоже подойдет для изучения под микроскопом. Однако клеточное строение таких препаратов для исследования может быть неразличимым, особенно при использовании маломощных приборов. Плюс потребуется немало усилий и много попыток до того, как получится идеальный препарат. Попытайтесь, например, срезать несколько раз кожицу со сливы, пока не выйдет подходящий многоклеточный слой. Или переберите сразу несколько сортов винограда (благо сегодня в гипермаркетах можно купить даже по несколько ягодок разных растений), пока не найдете тот, у которого красящие вещества кожуры имеют интересную форму.
Дальше переходите к клубням картофеля, которые тоже нужно окрашивать йодом согласно описанной выше процедуре. Но перед этим нарежьте картошку тончайшими ломтиками. Далее, из-за реакции с йодом на картошке проявятся пласты крахмала синего цвета.
Но самые доступные для исследований растения вроде листьев, травы или зеленых водорослей (найдете их в любых открытых водоемах). Чтобы увидеть хлоропласты, делайте срезы исключительно тонкими.
Хлоропласты – это зелёные пластиды, встречающиеся в клетках фотосинтезирующих эукариот. Фотосинтез происходит именно с их помощью.
Насекомые и представители водной фауны
Надоело смотреть на растения? Переходите к летающей и ползающей живности. Даже из квартиры не надо выходить. На балконе и под москитными сетками обычных окон, а также на ветровом стекле автомобиля собирается множество букашек, в том числе уже почивших. Это все ценный материал для Ваших исследований. На крыльях насекомых Вы увидите волоски, защищающие букашек от промокания. Поверхностное натяжение капли воды не дает ей коснуться крылышек. Приглядитесь!
Помните, как в детстве Вы ловили бабочек? А Вы не задумывались, что за пыль осыпается с ее крылышек?! Это микроскопические чешуйки разной формы, которые мы, как титаны, срываем небрежным касанием пальцев. Если вдруг поймаете моль, то используйте ее вместо бабочки.
Дальше присмотритесь к конечностям насекомых и пауков, изучите хитиновое строение пленки спины таракана. Вы удивитесь, но большое увеличение микроскопа поможет и здесь разглядеть сросшиеся чешуйки, из которых и состоят подобные пленки.
Естественно, не всем интересно смотреть на тараканов, поэтому просто выйдите на улицу, где поймать диковинное насекомое проще. Также загляните в ближайший водоем, в котором Вы обязательно отыщите мальков улитки, амеб, дафний (планктонных ракообразных), туфелек и циклопов. Малюсенький и оптически прозрачный детеныш улитки лучше всего подходит для изучения сердцебиения.
Рассмотрим пример исследования под микроскопом простейших живых организмов (из любого уличного водоема или домашнего аквариума), которые состоят всего из одной клетки:
- Возьмите из комплекта стекол предметное стекло с лункой. Очистите и обезжирьте его путем кипячения в слабом содовом растворе (чайная ложка на литр воды), а потом высушите досуха.
- Уложите в лунку несколько волокон ваты. Это замедлит исследуемых простейших.
- Пипеткой поместите воду на предметное стекло.
- Смажьте края покровного стекла парафином или вазелином (для предотвращения испарения влаги) и накройте им лунку основного стекла.
Можно проводить эксперимент с помощью обычных стекол без углубления – исследование в «раздавленной» капле. Чтобы не деформировать объект, гранями верхнего стекла проведите по пчелиному воску, образуя таким образом «ножки». По центру нижнего стекла разместите тончайший слой волокон ваты либо фильтрованной бумаги. Закройте препарат так, чтобы под верхнее стекло не попал воздух: подводим под углом нижнюю грань покровного стекла и плавно опускаем. В обоих случаях должна образоваться герметичная камера, в которой исследуемая жидкость долго не высыхает.
Не забывайте окрашивать препараты для лучшего наблюдения. Лучшим витальным красителем без токсического действия является нейтральный красный в концентрации не более 1 к 200 000. Неплохие результаты дает слабый щелочной раствор конго красного. Реактивы позволяют детально изучить простейших, не нарушая при этом их ритм жизни.
Освещение тоже важно! Для изучения живых организмов в готовых препаратах немного затемняйте поле зрения. В ярком проходящем свете важные аспекты строения простейшего почти неразличимы. Работу с увеличительным прибором следует начать с установки слабого увеличения при суженной диафрагме. После поэтапно увеличивайте картинку, поворачивая револьвер с объективами и настраивая механизм фокусировки.
В итоге запасайтесь баночками и пакетиками при любой вылазке на природу. В банку можно набрать воды из водоема, а в пакет заключить сорванные растения и высохшие останки насекомых. Соблюдайте осторожность, помня, что животные и их останки могут нести в себе различные заболевания. Надевайте перчатки, мойте руки и соблюдайте остальные правила элементарной гигиены.
![]()
Роман
Монтировки: Sky-Watcher EQ6 R PRO, EQ2, AZ2. Оптические трубы: рефрактор 70 мм f/10, рефрактор 90 мм f/10, Максутов-Кассегрен 127 мм f/12, рефлектор Ньютона 200 мм f/5. Камеры: Canon EOS 550D, ZWO ASI 120 MM mini, ZWO ASI 290 MC.
Для изучения микроорганизмов производят микроскопирование как живых, так и убитых микробов в неокрашенном и окрашенном виде. Микроскопический препарат готовят на предметном стекле - пластинке из тонкого стекла (76х26 мм) с хорошо отшлифованными краями. Предметные стекла, употребляемые при микробиологическом исследовании, должны быть кристально чисты и абсолютно обезжирены. На поверхности обезжиренного стекла вода легко расплывается и не образует капель шаровидной формы.
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 мин, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде. Стекла, бывшие в употреблении, необходимо обработать раствором серной кислоты в течение 2 ч, хорошо промыть в воде и прокипятить 10 мин в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тряпочкой.
В лаборатории всегда следует иметь запас готовых для работы стекол. Хранить предметные стекла лучше всего в банке с притертой пробкой, погруженными в смесь спирта с эфиром, взятых в равных объемах. Из банки предметные стекла достают пинцетом. Покровные стекла - вырезанные квадратом или прямоугольником тонкие стеклышки (толщиной 0,15-0,17 мм) размерами 18х18 мм, 20х20 мм, 18х24 мм.
Исследование микроорганизмов в живом виде
Микроорганизмы можно микроскопировать как в живом, так и в мертвом (фиксированном) состоянии на специально приготовленных препаратах. Плесневые грибы и дрожжи лучше рассматривать в живом виде в препарате «раздавленная» капля. Клетки этих микроорганизмов относительно крупные, и обычно при микроскопировании в живом виде хорошо выявляются их форма, размеры, некоторые детали внутреннего строения, а также характер размножения (почкование, деление, спорообразование и т.д.).
Бактерии ввиду их малых размеров чаще рассматривают в мертвом виде на фиксированных окрашенных препаратах. При этом получается более ясное представление о форме и размерах клеток, о способности их к спорообразованию. В живом виде в «раздавленной» капле бактерии рассматривают в том случае, когда выясняют их способность к движению.
Препарат «раздавленная» капля. На обезжиренное предметное стекло прокаленной петлей наносят каплю стерильной воды, в которую той же петлей вносят небольшое количество исследуемой культуры микроорганизма (дрожжей или бактерий), взятой с твердой питательной среды. Из жидкой среды культуру берут вместе с каплей жидкости, а при надобности добавляют каплю стерильной воды. Суспензия культуры микробов на стекле должна давать лишь слабую муть. При микроскопировании дрожжей в каплю жидкости на стекле добавляют петлей небольшое количество метиленовой сини (до голубого окрашивания) и всю эту смесь тщательно размешивают. Прижизненная окраска дрожжей метиленовой синью применяется для того, чтобы выявить мертвые клетки, легко окрашивающиеся в синий цвет. Живые клетки остаются неокрашенными, так как не пропускают краску через свою оболочку.
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми м окрашены в синий цвет.
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. На поверхность покровного стекла наносится капля иммерсионного масла, и препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X. При этом обязательно следует регулировать освещение с помощью диафрагмы для получения более четкого изображения рассматриваемых деталей.
При приготовлении препаратов в раздавленной капле нужно помнить следующее:
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимают кусочком фильтровальной бумаги.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если пузырьков много, препарат следует приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают немедленно (особенно живых бактерий), так как в противном случае вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки.
После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 сек, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
Исследование микроорганизмов в фиксированном и окрашенном виде
Приготовление мазка. На чистое обезжиренное предметное стекло платиновой петлей наносят материал (рис. 62). Если он жидкий, то каплю, взятую петлей, непосредственно равномерно распределяют по поверхности предметного стекла тонким слоем на площади примерно в 1 см2. Если же изучается агаровая культура, то на предметное стекло предварительно наносят каплю стерильной воды, в которой тонким слоем распределяется исследуемая культура. Получается так называемый мазок. Все манипуляции по приготовлению мазка необходимо выполнять с соблюдением правил асептики (над пламенем горелки стерилизуют петли, концы сосудов с исследуемым материалом, ватные пробки и пр.). Сделав мазок, его сушат при комнатной температуре, поместив на специальный сушильный столик (рис. 63). Хороший мазок после сушки должен давать едва заметный налет. Препарат с густым мазком для наблюдения малопригоден.
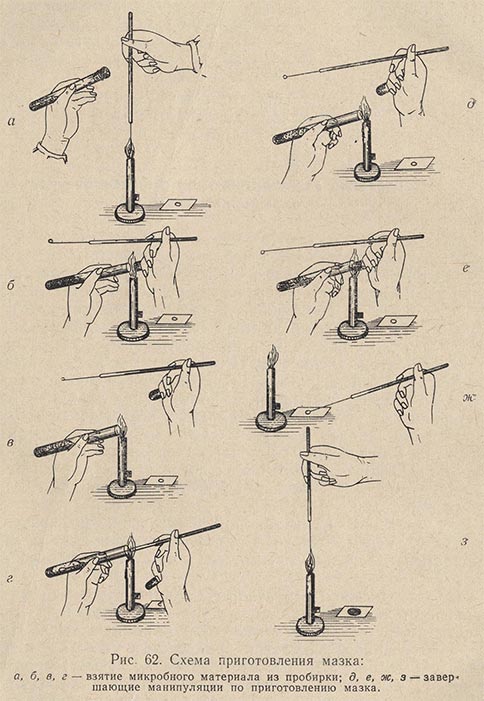
Для ускорения высыхания можно осторожно подсушить мазок над пламенем горелки. Предметное стекло в этом случае над пламенем горелки держат так, чтобы мазок был обращен вверх.
Фиксация мазка. Предметное стекло с высушенным мазком, обращенным вверх от пламени горелки, проводят 3-4 раза на границе между светлой и темной частью пламени. Цель фиксации - убить микробные клетки, прикрепить их к стеклу и облегчить окрашивание. Мертвые клетки гораздо лучше воспринимают краску, чем живые. Препарат в общей сложности не должен находиться в пламени более 2 сек. Излишнего нагревания мазков нужно избегать, так как при этом сильно изменяется структура клеток, мазок будет плохо окрашиваться. При недостаточной же фиксации мазка его можно смыть при последующей окраске. Практически достаточность нагревания определяют прикладывая предметное стекло к руке. При этом должен чувствоваться легкий ожог.
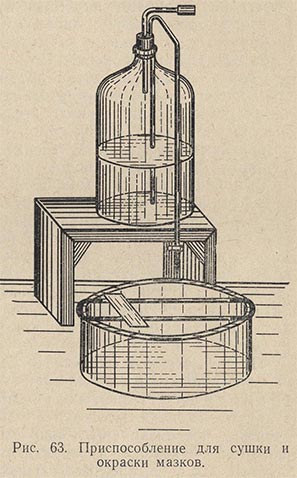
Окраска мазков. В лабораторной практике пользуются простыми и сложными методами окраски микробов. Сложные, или дифференциальные, способы окраски, как уже указывалось, применяются для детального изучения структуры клеток. При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленовой сини, разведенного фуксина и пр.). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок. Раствор краски в среднем выдерживают на мазке 2-3 мин (в зависимости от вида краски). Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 мин. Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 мин. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма. Раствор генцианвиолета держат для окраски 3-5 мин.
По истечении указанного срока краску сливают с предметного стекла. Если на мазок помещалась фильтровальная бумага, ее нужно осторожно снять пинцетом и затем промыть мазок легкой струей дистиллированной воды (можно и водопроводной). Струю воды следует направлять на ребро предметного стекла, а не на мазок. Промытый препарат высушивают на воздухе при комнатной температуре или с помощью полосок фильтровальной бумаги.
На сухой мазок наносят каплю кедрового масла. Не следует кедровое масло наносить на влажный (а тем более на мокрый) мазок. При этом возникает эмульсия воды в кедровом масле и четкость изображения в микроскопе резко снижается.
Сущность сложных методов окраски заключается в том, что препарат окрашивают не одной, а двумя и большим количеством контрастных красок. В микробиологической практике сложный метод окраски микробов по Граму имеет весьма важное значение при дифференциации микробов.
Техника окраски микробов методом Грама состоит в следующем. На фиксированный мазок кладут полоску фильтровальной бумаги и наливают карболовый раствор генцианвиолета на 1-2 мин. Затем краску сливают. Сняв бумажку и не промывая препарат водой, наносят на мазок раствор Люголя также на 1-2 мин (мазок чернеет). По истечении указанного времени раствор Люголя сливают с предметного стекла и погружают стекло в стаканчик со спиртом для обесцвечивания. Предметное стекло слегка покачивают в спирте, выдерживая 30-60 сек. Быстро промывают мазок водой и дополнительно окрашивают разведенным фуксином в течение 1-2 мин. Фуксин сливают, препарат промывают водой, высушивают и микроскопируют.
Выполнить окраску микробов по Граму можно, пользуясь модификацией этого метода, предложенной Синевым. Вместо раствора карболового генцианвиолета используют фильтровальную бумагу, пропитанную этим раствором и высушенную. На фиксированный мазок накладывают полоску такой бумаги, наносят несколько капель стерильной воды, так чтобы бумажка оказалась смоченной, и окрашивают препарат в течение 2 мин. Затем бумажку снимают, на препарат наливают раствор Люголя и далее поступают так же, как указано выше при окраске по Граму.
По отношению к окраске по Граму все бактерии разделяют на две группы: грамположительные (грампозитивные) и грамотрицательные (грамнегативные). Первые в результате окраски остаются окрашенными в фиолетовый цвет; вторые - обесцвечиваются спиртом и при дополнительном окрашивании фуксином приобретают красный цвет. Объясняется это тем, что у грамположительных бактерий в цитоплазме клеток содержатся специфические белки и магниевая соль рибонуклеиновой кислоты, которые с генцианвиолетом и йодом образуют комплекс фиолетового цвета, не разрушающийся под действием спирта. У грамотрицательных бактерий магниевая соль рибонуклеиновой кислоты в клетках отсутствует, и такого комплекса при окраске генцианвиолетом и йодом в цитоплазме не образуется. Генцианвиолет и йод в дальнейшем легко обесцвечиваются спиртом.
Приготовление красящих растворов
При бактериологическом исследовании для окраски микробов применяются основные анилиновые краски. Чаще всего употребляются: основной фуксин (красная краска), метиленовая синь (синяя краска), генцианвиолет, кристаллвиолет, метилвиолет (фиолетовые краски). Эти краски продаются в виде аморфных или кристаллических порошков, из которых готовят красящие растворы.
Исходным материалом для приготовления необходимых рабочих красок являются насыщенные спиртовые растворы указанных красителей. Спиртовые растворы готовят впрок и сохраняют в склянках с притертыми пробками. Сами по себе спиртовые растворы для окраски микробов не применяются.
Насыщенный спиртовой раствор красителя получают растворением 1 г его в 10 мл 96%-ного этилового спирта (этанола). Краска обычно полностью не растворяется, и на дне флакона остается небольшой осадок. Полученный спиртовой раствор настаивают 3-5 дней, ежедневно взбалтывая.
Рабочий водно-спиртовой раствор краски получают смешивая 1 мл насыщенного спиртового раствора с 10 мл дистиллированной воды. Для повышения красящей способности в качестве протравы к водно-спиртовым растворам красок добавляют карболовую кислоту.
Рецепты приготовления наиболее употребительных красок.
Карболовый фуксин Циля. 10 мл насыщенного спиртового раствора основного фуксина смешивают со 100 мл 5%-ной карболовой кислоты. Можно приготовить красящий раствор и непосредственно из сухого красителя. Для этого 1 г основного фуксина растирают в ступке с 5 г кристаллической карболовой кислоты. Для лучшего растирания рекомендуется добавить несколько капель глицерина. Затем понемногу приливают 10 мл 96%-ного спирта. К равномерно растертой массе постепенно приливают 100 мл дистиллированной воды, перемешивают и оставляют на 1-2 суток. Затем фильтруют через бумажный фильтр. Фуксин Циля стоек и может сохраняться очень долго. Его употребляют для окраски спор и кислотоустойчивых бактерий, трудно воспринимающих краску.
Фуксин Пфейфера (разведенный фуксин). 1 мл карболового фуксина Циля смешивают с 9 мл дистиллированной воды. Раствор нестоек, поэтому его приготовляют непосредственно перед окраской препаратов. Используют для простой окраски мазков и дополнительной окраски их по методу Грама.
Карболовый генцианвиолет. 10 мл насыщенного спиртового раствора генцианвиолета смешивают со 100 мл 5%-ной карболовой кислоты или 1 г генцианвиолета растирают в ступке с 5 г кристаллической карболовой кислоты, постепенно добавляют 10 мл 96%-ного спирта и 100 мл дистиллированной воды.
Щелочная метиленовая синь (по Лефлеру). К 100 мл дистиллированной воды прибавляют 30 мл насыщенного спиртового раствора краски и 1 мл 1%-ного раствора едкого кали (КОН). Раствор фильтруют. Краска очень прочная, причем красящая способность старой краски выше, чем свежеприготовленной.
Водный раствор метиленовой сини. 1 г метиленовой сини растворяют в 100 мл дистиллированной воды.
Раствор Люголя. 2 г йодистого калия растворяют в 5 мл дистиллированной воды, прибавив 1 г кристаллического йода. Объем доводят водой до 300 мл. Раствор Люголя должен иметь слабощелочную или нейтральную реакцию. При кислой реакции его нейтрализуют (по лакмусу) двууглекислой содой. Раствор следует хранить в склянках из темного стекла, предохраняя от действия света.
Приготовление пропитанной генцианвиолетом фильтровальной бумаги для окраски микробов по Граму в модификации Синева. Раствор карболового генцианвиолета помещают на сутки в термостат при 37 °С, затем фильтруют через бумажный фильтр. Фильтрат выливают в тарелку и погружают в него нарезанную полосками фильтровальную бумагу на 1-2 мин. Пропитанная краской бумага подсушивается, нарезается кусочками (2х4 см) и сохраняется в темных склянках с притертой пробкой. Срок хранения неограниченный.
Примечание. Свежеприготовленные карболовые растворы красок имеют на поверхности пленку с металлическим блеском. Эти растворы стойкие и сохраняются довольно долго. Однако при слишком длительном хранении они могут стать непригодными; в этом случае металлический блеск на поверхности их пропадает, а на дне образуется мелкий порошкообразный осадок.
Мы часто получаем письма, подобные тому, выдержки из которого приведены ниже.
«. Зарплата маленькая, денег у школы нет на абсолютно необходимые вещи. Ученики не могут приобрести учебники. Компьютеры были и остаются мечтой совершенно недосягаемой. И в лучшие-то времена пособий не хватало, что уж теперь говорить. Газеты объединения «Первое сентября» – единственный на сегодня относительно доступный по цене источник, из которого можно получить свежую информацию. Подскажите, что делать, если нет возможности. » – далее идет перечисление, чего именно нет.
В редакции встретились два письма. К.С. В-ва пишет: «. Работаю биологом в школе уже несколько лет. Пользуюсь в основном наследством, оставшимся от застойных времен, которые все так дружно ругали. Я не жалуюсь, в школе даже микроскопы сохранились. Но как ни стараемся мы, микропрепараты нет-нет, да и бьются или давятся неопытными руками. Когда возможно, делаем временные, но это требует, простите за невольный каламбур, времени, которого на наш предмет и так не много. Может, подскажете какой-нибудь способ изготовления постоянных препаратов на основе подручных материалов? Ни о канадском, ни о пихтовом бальзаме я не заикаюсь. »
Ответ на просьбу мы нашли в письме нашей постоянной читательницы А.Н. Сергеевой. Вот что она пишет.
«Перед учителями биологии и руководителями кружков рано или поздно встает задача изготовить учебный микропрепарат. Нам хотелось подобрать вещество, способное надолго зафиксировать биологический объект, сделать эту процедуру простой и доступной. Известные бальзамы (смолы-фиксаторы) никогда не относились к легкодоступным веществам, особенно в удалении от крупных городов. Кроме того, где-то мы слышали, что вещества эти не безвредны. И, наконец, сам процесс их использования, который мы когда-то изучали в институте, был довольно непрост. Решение подсказал случай.
Как в любой небольшой школе, приходилось совмещать различные виды учебно-образовательной деятельности, часто смежные, а то и далекие от основного предмета. Но особенно привлекало что-нибудь такое, что все-таки имело отношение к природе, например составление композиций и изготовление поделок из природных материалов. Одной из непременных принадлежностей такой работы были различные виды клея.
Всем, наверное, известно, что, к сожалению, с лаками и клеями надо работать очень аккуратно. Дело не только в том, что будет испорчена, например, одежда, всегда можно подобрать такой костюм, который не очень жалко. Самое обидное то, что пролитый клей или лак обычно оставляет незаметные поначалу пятна на детских работах. Со временем эти пятна желтеют, буреют и безнадежно портят изделия. Приходится их реставрировать или убирать, а то и выбрасывать, что не радует никого.
На курсах повышения квалификации, кажется, в 1975 или даже 1973 г., нам показывали приемы работы с обычной соломкой. Оказалось, что ее очень легко выгладить тупой стороной ножа или любым подходящим предметом в красивые блестящие полоски, которые можно затем клеить на бумагу или ткань, составляя целые картины. (Мы для простоты склеивали из полосок что-то похожее на древесные листья, подбирая соломку других цветов для жилок и черешков.) Тогда же руководитель этих занятий объяснил нам, что для склеивания нужно пользоваться клеем ПВА (поливинилацетатным), поскольку его капли образуют прозрачную, долго сохраняющую эластичность пленку, а главное – не портят бумагу, в отличие, например, от силикатного клея.
Как мы позже опытным путем выяснили, этим клеем ПВА можно успешно пользоваться как заменителем лака, покрывая им, например, раскрашенные самодельные брошки из необожженной глины. После застывания клей, видимо, полимеризуется и даже приобретает изрядную водостойкость. Случайные брызги воды работам с таким покрытием не страшны.
Использовать клей ПВА для изготовления препарата мы попробовали в 1985 г. Важно, чтобы препарат был влажный, хорошо смоченный, а клей – свежий и чуть разбавленный чистой холодной кипяченой водой до нужной концентрации (клей представляет собою эмульсию и легко разводится). После нескольких проб и ошибок нужную концентрацию вы сможете составлять и определять без труда.
Дальше все просто. На чистое предметное стекло нанесите каплю воды – кипяченой или, если вы дружите с учителем химии, дистиллированной. Воду надо аккуратно удалить чистой, не оставляющей волосков тканью или фильтровальной бумагой так, чтобы стекло было чуть влажным. Это, как и влажность образца, способствует равномерному (без пузырьков) смачиванию. На подготовленную поверхность нужно нанести небольшую каплю заранее приготовленного клея ПВА так, чтобы не появились пузырьки воздуха. Они иногда и не мешают, но внешний вид препарата портят. В эту каплю аккуратно переносят заранее подготовленный срез или образец, например, предварительно умерщвленную горячей водой дафнию (умерщвление преследует сразу две цели – я не хочу воспитывать в детях бесцельную жестокость, с другой стороны – неподвижное животное при наличии элементарных навыков работы с препаровальной иглой можно расположить в капле клея так, чтобы впоследствии его было удобно рассматривать). Затем плавным наклонным движением (сначала капли касается один край стекла, как при изготовлении временного препарата) надо сверху положить покровное стекло, также чистое и слегка влажное. Слой клея между стеклами должен быть как можно более тонким.
Если что-то не удалось, а образец ценный и достаточно крупный, почти всегда, в отличие от смол, есть возможность его отмыть простой водой и процедуру повторить. Излишки клея аккуратно смываются тонкой струйкой воды; нужно следить, чтобы она не затекала между стеклами. Покровное стекло необходимо придерживать. Чуть мутноватые остатки воды можно аккуратно удалить фильтровальной бумагой, а лучше – полоской тонкой ткани без ворса (если ее сразу тщательно сполоснуть, ткань можно использовать многократно – клей, пока не высох, отстирывается начисто).
Готовые препараты надо разложить в теплом сухом месте. Индикатором готовности препарата служит его прозрачность. В зависимости от очень многих факторов высыхание до прозрачного состояния продолжается от одной до четырех недель. Бывает, что слишком толстый слой клея или клей, загрязненный примесями, полностью прозрачным не становится – это несколько ухудшает изображение, но благодаря небольшой глубине резкости микроскопа даже такие препараты доступны для изучения.
Первым препаратам, изготовленным таким образом, уже более 15 лет. Они до сих пор вполне пригодны».
Мы не гарантируем, что предложенный метод можно применять для изготовления любых препаратов, поскольку некоторые из них требуют окрашивания, а красители могут взаимодействовать с клеем. Однако мы не сомневаемся, что опыт преподавателя может оказаться полезным во многих случаях.
Тема: Техника изготовления временных микропрепаратов
Материалы. Листья традесканции виргинской (Tradescantia virginica), подсолнечника (Helianthus annuus); тычинки из цветков мальвы (Malva sp.), зафиксированные в 90-96%-ном спирте; комплект постоянных микропрепаратов "Анатомия растений"; лактофенол, сернокислый анилин.
Для изучения растительных объектов с помощью светового микроскопа необходимо приготовить микропрепарат. Микропрепараты, не предназначенные для длительного хранения, называются временными. Изучаемый объект помещают на предметное стекло в каплю воды, глицерина, раствора, реактива или красителя и накрывают покровным стеклом. Такие препараты можно хранить в течение нескольких дней, поместив во влажную атмосферу.
Если объекты помещают в бальзам, глицерин с желатиной или целлоидин, препараты сохраняются годами и называются постоянными.
Некоторые растения или их органы (водоросли, споры, пыльца и др.) можно рассматривать под микроскопом целиком, без предварительного изготовления срезов. Такие препараты называются тотальными.
Однако число объектов, которые можно изучать на тотальных микропрепаратах невелико. Чаще приходится делать срезы органов, подлежащих изучению. Срезы изготавливают из свежих или фиксированных частей растений. Обычно для фиксации употребляют растворы спирта или формалина. Сделанные срезы должны быть очень тонкими и прозрачными. Различают следующие виды срезов: поперечный и продольный ( радиальный, тангентальный, парадермальный) (рис. 5, Б).
Поперечный срез проходит перпендикулярно оси органа и позволяет изучить строение органа в поперечном сечении.
Продольный радиальный срез проходит по радиусу оси органа и дает возможность изучить строение органа в продольном сечении.
Продольный тангентальный срез проходит перпендикулярно радиусу цилиндрической структуры, например, корня или стебля; в случае вторичных ксилемы и флоэмы проходит под прямым углом к сердцевинным лучам.
Парадермальный срез (греч. пара + дерма - кожа) - сечение, параллельное поверхности плоской структуры, например, листа (срез эпидермы листа).
Правила изготовления анатомических срезов
При изготовлении временных микропрепаратов необходимо соблюдать следующую последовательность операций:
Вымыть и тщательно вытереть предметное и покровное стекла. Чтобы не сломать очень хрупкое покровное стекло, надо поместить его в складку салфетки между большим и указательным пальцами правой руки и осторожно вытереть его круговыми движениями пальцев;
Нанести на предметное стекло пипеткой каплю жидкости (воды, глицерина, раствора, реактива или красителя);
Сделать срез изучаемого органа при помощи лезвия. Лезвие должно быть очень острым. Для изготовления срезов, мелкие объекты поместить между кусочками из сердцевины бузины или пенопласта (рис. 5, А). Лезвием выровнить верхнюю поверхность пенопласта вместе с объектом. Затем сделать тонкий срез, ведя лезвием к себе наискось одним плавным и быстрым движением. При этом объект держать строго вертикально, а лезвие - строго горизонтально. Обе руки должны быть совершенно свободны. Не следует ими опираться на стол или прижимать к груди (рис. 6). Сделать сразу несколько срезов. Лезвие и объект все время смачивать.
Выбрать самый тонкий срез, перенести его с помощью препаровальной иглы или тонкой кисточки в центр предметного стекла в каплю жидкости;
Закрыть срез покровным стеклом так, чтобы под него не попал воздух. Для этого покровное стекло взять двумя пальцами за грани и подвести под углом нижнюю грань к краю капли жидкости и плавно его опустить;
Если жидкости много, и она вытекает из-под покровного стекла, удалить ее при помощи фильтровальной бумаги. Если же под покровным стеклом остались места, заполненные воздухом, то добавить жидкость, поместив ее каплю рядом с краем покровного стекла, а с противоположной стороны фильтровальную бумагу.
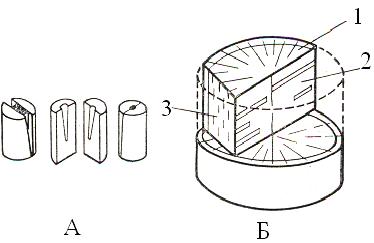
Рис. 5. Закладка объекта в сердцевину бузины (А) и сечения цилиндрического органа (Б):
1 - поперечное, 2 - продольное радиальное, 3 - продольное тангентальное.
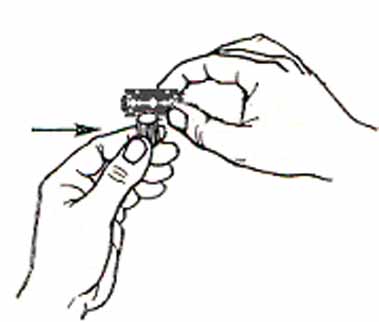
Рис. 6. Положение рук при изготовлении среза.
Задание 1. Приготовить 2 тотальных микропрепарата пыльцы мальвы (Malva sp.): пыльца в воздухе (без покровного стекла) и в лактофеноле. Рассмотреть оба препарата при малом увеличении, отметив особенности сред, в которые помещены пыльцевые зерна. Исследовать строение пыльцы при большом увеличении микроскопа. Сделать рисунок.
Последовательность работы. На середину предметного стекла пипеткой нанести каплю спирта с пыльцой. После высыхания спирта, препарат положить на предметный столик микроскопа и рассмотреть пыльцевые зерна в окружении воздуха. Показатели преломления стекла, воздуха и пыльцы существенно различаются. Поэтому в воздушной среде видны лишь грубые и сильно затемненные элементы структуры. Чтобы избежать не желательных оптических явлений, надо рассмотреть пыльцу в среде, показатель преломления которой близок к показателю преломления стекла. Такой средой служит лактофенол. Стеклянной палочкой на объект нанести каплю лактофенола, затем накрыть его покровным стеклом.
Готовый микропрепарат поместить на предметный столик и исследовать. При малом увеличении видны крупные шаровидные пыльцевые зерна с шиповидными выростами на поверхности (рис. 7). При большом увеличении и перемещении тубуса с помощью микрометренного винта пыльцевые зерна рассмотреть в разных плоскостях: то с поверхности, то в оптическом разрезе. На поверхности пыльцевого зерна хорошо видны выросты стенки. Ближе к периферии они кажутся удлиненными и заостренными, ближе к центру - более шаровидными, а в проекции они имеют вид небольших окружностей. Кроме выростов, на поверхности расположены ростковые поры, через которые в период прорастания пыльцы выходят пыльцевые трубки.
Слегка опустить тубус с помощью микрометренного винта и рассмотреть густое темное внутреннее содержимое (которое отстало от стенки вследствие обезвоживания его спиртом) и две стенки: внутреннюю тонкую - интину и наружную толстую с шаровидными выростами - экзину . После детального исследования при большом увеличении зарисовать одно пыльцевое зерно и обозначить экзину, шиповидные выросты, ростковую пору, интину, внутреннее содержимое.
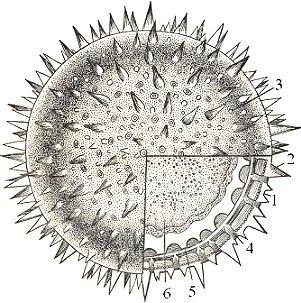
Рис. 7. Пыльцевое зерно мальвы (Malva sp.) (часть зерна в оптическом разрезе):
1 - экзина, 2 - шиповидный вырост, 3 - ростковая пора (вид сверху), 4 - ростковая пора (вид сбоку), 5 - интина, 6 - внутреннее содержимое.
Задание 2. Приготовить временный препарат парадермального среза эпидермы с нижней стороны листа традесканции виргинской (Tradescantia virginica) в капле воды, и рассмотреть его под микроскопом.
Последовательность работы. Для изготовления препарата лист традесканции обвернуть вокруг указательного пальца левой руки так, чтобы нижняя сторона фиолетового цвета была обращена наружу. Правой рукой при помощи препаровальной иглы надорвать эпидерму над средней жилкой в средней части листа и пинцетом снять ее кусочек. При этом невольно захватывается и часть мякоти листа (мезофилла), но обычно можно найти тонкий участок на периферии, состоящий из одного ряда клеток эпидермы. Сорванный кусочек положить на предметное стекло в каплю воды наружной стороной вверх и накрыть покровным стеклом. При малом увеличении рассмотреть вытянутые клетки в виде шестиугольников, бесцветные или окрашенные в бледно-фиолетовый цвет благодаря присутствию в вакуолях пигмента антоциана.
Задание 3. Научиться изготовлять разные виды срезов (поперечный, продольный радиальный, продольный тангентальный) из стебля подсолнечника (Helianthus annuus) и делать из них микропрепараты. Рассмотреть их под микроскопом.
Последовательность работы. Свежесрезанные или фиксированные междоузлия стебля (длиной 2 - 3 см , толщиной 7- 8 мм ) разрезать вдоль на 2 части. Невооруженным глазом или с помощью лупы на поперечном сечении стебля можно выделить две зоны: наружную - неоднородную, состоящую преимущественно из плотно сомкнутых клеток, и внутреннюю - рыхлую, построенную однородно.
Поперечные срезы. С выровненной поверхности одной из половинок сделать лезвием несколько поперечных срезов. Эти срезы должны захватить как периферическую часть, так и часть рыхлой сердцевины. С помощью препаровальной иглы или кисточки срез поместить в центр предметного стекла, окрасить его раствором сернокислого анилина, накрыть покровным стеклом и рассмотреть под микроскопом.
Продольные срезы. Для изготовления продольного радиального среза разрезать вдоль кусочек стебля подсолнечника так, чтобы разрез прошел через середину одного из крупных пучков, и с полученного радиального разреза сделать лезвием несколько тонких срезов. Срез поместить на предметное стекло, окрасить сернокислым анилином, накрыть покровным стеклом и рассмотреть под микроскопом.
Для изготовления продольного тангентального среза разрезать кусочек стебля подсолнечника перпендикулярно радиусу стебля, так чтобы он проходил под прямым углом к сердцевинным лучам. Произвести его окрашивание сернокислым анилином.
Одревесневшие оболочки клеток окрасятся в лимонно-желтый цвет.
Задание 4. Рассмотреть несколько постоянных микропрепаратов из комплекта "Анатомия растений". Сравнить временные и постоянные микропрепараты стебля подсолнечника.
Контрольные вопросы
1.Чем отличается временный микропрепарат от постоянного?
2. Как правильно изготовить временный микропрепарат?
- 08 января 2009 28 Comments -->микробиологияиммунологиябактериявозбудительвирусологияэпидемиологиямикроскопиясуспензияфиксатор
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
- Устанавливают микроскоп в рабочее положение, т.е. так, чтобы колонка была обращена в сторону исследователя, а зеркало - в направлении источника света.
- Ставят под тубус, пользуясь револьвером, объектив малого увеличения. Как правило, предмет рассматривают вначале при малом увеличении.
- Проверив, открыта ли диафрагма и поднят ли конденсор, вращают, глядя в окуляр, зеркало и устанавливают его так, чтобы поле зрения оказалось хорошо освещенным.
- Помещают препарат на предметный столик микроскопа так, чтобы рассматриваемый объект оказался над отверстием столика. Препарат закрепляют с помощью клемм.
- Находят фокусное расстояние, для чего опускают или поднимают тубус с помощью макрометрического винта. Для окончательной фокусировки пользуются микрометрическим винтом.
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Препараты готовят, как правило, на предметных стеклах, толщина которых не должна превышать 1,2 - 1,4 мм. Применение более толстых стекол не позволяет получить резкое изображение краев диафрагмы осветителя в плоскости препарата. Поверхность стекла должна быть тщательно очищена и обезжирена, чтобы капля жидкости равномерно расплывалась по стеклу. Это достигается протиранием стекол ватой, смоченной эфиром (после этого промывание водой не требуется), или обжиганием поверхности стекол в пламени горелки (жир при этом сгорает).
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
1. «Раздавленная капля». На предметное стекло наносят каплю водопроводной воды и помещают в нее небольшое количество клеток изучаемых микроорганизмов, размешивают и накрывают покровным стеклом. Микроорганизмы, выращенные на плотной питательной среде, переносят в каплю воды бактериологической петлей, выращенные в жидкой среде - стерильной пипеткой. В этом случае каплю воды на предметное стекло можно не наносить. Капля исследуемого материала должна быть настолько мала, чтобы после прижимания ее покровным стеклом не было избытка жидкости, выступающего из-под него. В противном случае избыток жид кости необходимо удалить фильтровальной бумагой.
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
1. Приготовление мазка. На обезжиренное спиртом предметное стекло помещают маленькую каплю водопроводной воды и переносят в нее петлей небольшое количество исследуемого материала как для препарата «раздавленная капля». Полученную суспензию равномерно размазывают петлей на площади 1 - 2 см2 возможно более тонким слоем. Мазок должен быть настолько тонок, чтобы высыхал после приготовления.
2. Высушивание мазка. Лучше всего сушить готовый препарат при комнатной температуре на воздухе. Хорошо приготовленный тонкий мазок высыхает быстро. Если высушивание мазка замедлено, то препарат можно слегка нагреть в струе теплого воздуха высоко над пламенем горелки, держа стекло мазком вверх. Эту операцию следует проводить осторожно, не перегревая мазка, иначе клетки микроорганизмов деформируются.
3. Фиксация препарата преследует несколько целей: убить микроорганизмы, то есть сделать безопасным дальнейшее обращение с ними; обес печить лучшее прилипание клеток к стеклу; сделать мазок более восприимчивым к окраске, так как мертвые клетки окрашиваются лучше, чем живые. Самым распространенным способом фиксации является термическая обработка. Для этого препарат трижды проводят через наиболее горячую часть пламени горелки, держа предметное стекло мазком вверх. Не следует перегревать мазок, так как при этом происходят грубые изменения клеточных структур, а иногда и внешнего вида клеток, например их сморщивание. Для исследования тонкого строения клетки прибегают к фиксации различными химическими веществами. Фиксирующую жидкость наливают на мазок, либо препарат на определенное время погружают в стакан с фиксатором.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Читайте также:

