Что такое кос в химии
Опубликовано: 17.09.2024

Понятие кислотно-основного состояния или равновесия (КОС) заключается в следующем: это довольно постоянная величина соотношения кислоты к основанию плазмы крови живого организма. Аналогичные ему названия – реакция, равновесие, равновесие кислот и щелочей. Показатель этот один из компонентов гомеостаза. Количественное определение такого равновесия исчисляется содержанием протонов, то есть концентрацией ионов водорода. Иначе это называется водородным показателем pH.
Кислотно-основное состояние (КОС) – важная характеристика крови. Оно колеблется в течение жизни, но не на критических показателях. Постоянство этой величины необходимо для полноценности метаболических процессов в организме, обеспечения нормального сохранения активности ферментов, а также интенсивности обмена веществ и его направленности.
Немного физики
Любая жидкость может быть охарактеризована как кислотная или щелочная. Зависит и определяется это содержанием в ней количества протонов (название свободных водородных ионов). Это же касается и крови. Сегодня кислотность любой жидкой среды определяется таким понятием, как водородный показатель - рН (power hydrogen — «сила водорода»). Шкала и определение рН (от 0 до 14) в 1908 г. была введена датским биохимиком и физиком Сереном Петером Лаурицем Сервисеном.
Нейтральная реакция жидкости – ее рН - равняется 7 единицам. При меньших его значениях говорят о повышении кислоты, большие значения превращают жидкость в щелочную.
Понятие о кислотно-основном состоянии организма и его постоянство поддерживается 2 составляющими – БР (буферные растворы или системы) и физиологической компенсацией за счет органов – почек, легких, печени.
Механизм

Патофизиология кислотно-основного состояния - любые ткани живого работающего организма всегда оказываются чувствительными к сдвигам pH в любую сторону. Если он превышен и реакция щелочная, тут же начинается разрушение клеток, белки сворачиваются (денатурируются), ферменты инактивируются, и организм может погибнуть.
Электролиты крови - кислоты, щелочи и соли, которые под воздействием воды распадаются на катионы и анионы. Постоянство или регуляция кислотно-основного состояния происходит за счет, как было сказано, буферных систем. Их основное предназначение – противодействие резким колебаниям содержания протонов.
Эти растворы имеют свойство держать уровень ионов водорода постоянным даже при добавлении к ним кислот или щелочей или при их разведении. Состав буфера – это смесь какой-либо слабой кислоты с ее же основанием, но с сильным анионом, то есть это кислотно-основная пара. Например, такой системой можно назвать карбонатную кислоту: Н2СО3 и NaHC03.
В крови постоянно действуют и существуют несколько основных буферных систем:
- Бикарбонатная (смесь Н2СО3 и НСО3) – занимает 53 % буферной емкости крови и является самой мощной.
- Система гемоглобин — состоит из оксигенированного гемоглобина (слабая кислота) и неоксигенированного (или дезоксигемоглобина). Это слабое основание – ННв-КНвО2) – 35 %. Оксигемоглобин в 80 раз больше отдает в среду протонов.
- Белковая буферная система – это, в первую очередь, альбумин крови, поэтому для внутренней среды клеток он главный. Данный буфер занимает всего 5-7 % от емкости крови. Работает он благодаря амфотерным свойствам белка. В кислой среде альбумин становится катионом, в щелочной – выступает как кислота. Такое свойство называется способностью к ионизации.
- Фосфатная система (дифосфат-монофосфат – NaH2РО4 и NaHPO4) – составляет 2-5 % плазмы крови.
Значение каждой буферной системы
Бикарбонатная буферная система (наиболее управляемая среди других) имеет особенно важное значение: при избытке протонов происходит реакция с ионами бикарбоната (HCO3−) и образуется Н2СО3 – угольная кислота. Это не что иное, как раствор углекислого газа в воде. Далее ее количество уменьшается за счет распада этой кислоты с образованием углекислого газа, выводимого легкими. Деятельность этого буфера имеет неразрывную связь с вентиляцией легких.
Гемоглобиновый буфер зависим от работы легких, связан с оксигенацией, то есть насыщения кислородом. Кислород потенцирует данный буфер, т. е. определяется активностью дыхательной системы.
Белковая система отвечает за нейтрализацию продуктов метаболизма.
Концентрация фосфатного буфера сосредоточена, в основном, в таком месте почек, как канальцы и внутриклеточном пространстве. Только от него зависит кислотно-основная реакция мочи - дигидрофосфат (H2PO4). А вот NaHCO3 в канальцах почек всасывается обратно.
Физиологические процессы компенсации

Значение работы почек в регуляции КОС выражено в том, что они связывают и выводят ионы водорода и возвращают в кровь ионы натрия и бикарбоната. Поэтому регуляция кислотно-основного состояния почками зависит от водно-солевого обмена. Метаболическая почечная компенсация работает медленно – компенсация наступает в течение 9-12 ч.
Что происходит в почечных канальцах: в них происходит секреция ионов водорода. Здесь они соединяются с ионами бикарбоната (NaHC03 и КНСОз). Образуется угольная кислота (Н2СО3). Она, в свою очередь, легко диссоциирует на углекислый газ и воду, при излишке которых они также выводятся легкими и почками. Одновременно высвободившиеся катионы натрия и калия эквивалентно заполняют канальцы снова, они опять участвуют в дальнейшем образовании бикарбонатов.
В результате всех этих превращений щелочность крови сохраняется. Минус только в медленности действия почек. Константа кислотно-основного состояния определяется также активной работой печени. Она окисляет большинство органических кислот, а неорганические удаляет вместе с желчью.
Лактат преобразуется в печени в гликоген (животный крахмал). Панкреатический, кишечный (щелочная реакция) и желудочный соки также участвуют в метаболической компенсации.
Кислотно-основное состояние крови человека в норме проявляет себя как слабощелочная жидкость. При этом рН артериальной крови равен 7,35-7,47, а венозной крови на 0,02 ниже. Кислота становится донором ионов водорода, основание их связывает и называется акцептором.
Легкие в поддержании постоянства КОС играют главную роль, потому что через них выделяется 95 % кислых валентностей в виде углекислоты.
В сутки выделяется легкими 15 тыс. ммоль углекислоты, а почки, к примеру, могут выделить всего 40-60 ммоль. То есть дыхание человека – это и есть работа легких в поддержании гомеостаза.
Недостаточная вентиляция легких повышает парциальное давление углекислого газа в альвеолярном воздухе и создается альвеолярная гиперкапния. Соответственно, увеличивается объем СО2 в артериальной крови и здесь также возникает уже артериальная гиперкапния. При слишком большом повышении PaCO2 или длительной гиперкапнии дыхательный центр угнетается с понижением его чувствительности к CO2.
При гипервентиляции легких картина противоположная и характеризуется она гипокапнией – альвеолярной и артериальной. Колебания углекислоты вызывает респираторные сдвиги кислотно-основного равновесия.
Легочный механизм компенсации происходит чрезвычайно быстро (коррекция изменений рН в щелочную сторону при ацидозе происходит буквально за 1-3 минуты) и является очень чувствительным. Гораздо быстрее действуют буферные системы – им нужно для компенсации всего 30 сек.
Виды нарушений

Они развиваются при многих патологических состояниях, и регуляторные механизмы в таких случаях могут не срабатывать. В зависимости от сдвига рН, могут развиться ацидоз и алкалоз. Причины смещения - дыхательные (респираторные) и метаболические (обменные) сдвиги. Соответственно, развивается алкалоз или ацидоз респираторный или метаболический. Системы регуляции кислотно-основного состояния крови стремятся скорее ликвидировать возникшие изменения, причем при респираторных нарушениях подключаются в помощь механизмы метаболической компенсации, а при метаболических нарушениях – респираторные.
Диагностика КОС
Для анализа кислотно-основного состояния крови может браться из вены или пальца – любая. Дело в том, что кровь из пальца может считаться артериализованной, поскольку ее показатели близки к показателям крови из артерий, которые считаются наиболее пригодными и чистыми для исследований.
Капиллярную кровь собирают в стеклянные колбы объемом 50 мкл или специальные пробирки с антикоагулянтами.
Более постоянной считается артериальная. Объем забираемой крови – 0,1-0,2 мл – буквально несколько капель. Определение рН крови проводится электрометрическим способом с помощью стеклянных рН-электродов. Кислотность крови может определяться и другими способами: по цвету конъюнктивы (система В. Караваева), в домашних условиях.
Цвет конъюнктивы определяется оттягиванием нижнего века. Бледно-розовая конъюнктива – ацидоз, темно-розовая – алкалоз, яркая – норма.
Моча для определения не используется, рН организма она точно не покажет.
Методов в домашних условиях несколько: при помощи лакмусовой бумажки, электронного прибора, по цвету конъюнктивы и по нижнему давлению и пульсу.
Эти методы оперативные и могут использоваться в срочных случаях, хотя и не совсем точны по сравнению с лабораторными данными.
Для исследования газов крови и определения PaCO2 в крови используется метод Аструпа с одноименным электродом или электрод Северингхауса. Полученные значения рассчитывают с помощью номограммы.
Влияние кислотно-основных состояний крови

На этот счет имеются точные научные факты и доказательства. Исследование показателей кислотно-основного состояния крови подтверждают, что изменения pH больше, чем на 0,4, с жизнью несовместимы. Число ионов водорода в плазме в норме составляет 40 нмоль/л, размах – от 36 до 45. Это значение соответствует рН 7,4. О полной компенсации можно говорить при колебаниях рН в пределах 7,35-7,45.
Далее происходит уже нарушение кислотно-основного состояния и трактовка его может быть двоякой:
- Ацидоз - субкомпенсированный (рН 7,25-7,35), декомпенсированный (рН 7,55).
Колебания рН выглядят как будто незначительными, но такое впечатление складывается из-за шкалы логарифмов. На самом деле разница даже всего лишь в единицу рН означает увеличение концентрации протонов в 10 раз.
Метаболические нарушения
Буферные основания (Buffer Base, ВВ) — сумма всех анионов в крови. Какие анионы могут содержаться в плазме - натрий, фосфор, хлор, калий и железо. Они связаны с уменьшением или увеличением нелетучих кислот в крови. А ВЕ – это разница между ВВ и должным содержанием (концентрацией) буферных оснований. Их количество от напряжения СО2 не зависит.
В норме содержание ВВ выражается как 48,0 ± 2,0 ммоль/л. Референтное содержание ВЕ составляет 2,5 ммоль/л. На практике главным показателем является именно ВЕ.
В состоянии ацидоза основания в дефиците и ВЕ снижаются. Таким образом, величина BE - наиболее информативный показатель метаболических нарушений кислотно-основного состояния со знаком + или –. Дефицит оснований – это ацидоз, избыток за пределы нормы колебаний – метаболический алкалоз.
Итак, виды нарушений кислотно-основного состояния могут проявляться в алкалозе, ацидозе – респираторном или метаболическом.
Метаболический (обменный) ацидоз возникает при накоплении недоокисленных продуктов распада, т. е. нелетучих кислот. Такое нарушение развивается с дефицитом поступления кислорода, нарушениях кровотока в сосудах, нарушениях углеводного обмена с накоплением кетоновых тел в крови при диабете, острой почечной и печеночной недостаточности, выраженной диарее, недостаточности сердечной деятельности, любом виде шока, отравлении древесным спиртом, антифризом, салицилатами и др.
Для его компенсации организм подключает дыхательный алкалоз, развивающийся с гипервентиляцией легких на фоне дыхания Куссмауля. Это патологическое дыхание ацидотическое, ассоциируется с гипервентиляцией легких.
Метаболический (обменный) алкалоз могут вызывать тяжелые электролитные нарушения. По сравнению с ацидозом, он встречается реже. Его причинами могут стать введение NaHCO3 при диффузиях растворов в избыточном количестве, употребление ощелачивающих продуктов (растительные, молочные), неукротимая рвота с потерей хлоридов, прием диуретиков, которые вызывают потерю калия и выведение тех же хлоридов, избыточная продукция альдостерона корой надпочечников в результате гиповолемии. Сюда же относится и сам гиперкортицизм, при переливании достаточно большого объема крови, хранившейся с цитратом натрия, т. е. с содержанием окислов азота. Респираторные нарушения КОС (кислотно-основного состояния) могут возникнуть при неадекватной вентиляции легких и колебаниях СО2 в крови.
Респираторный (дыхательный) алкалоз возникает при гипервентиляции – произвольной и непроизвольной. У здоровых людей такое состояние может возникнуть при большом подъеме в горы, при марафонском беге, эмоциональном возбуждении. У больных – при сердечных и легочных патологиях, когда имеется одышка. При выраженной гипокапнии (PaCO2 ниже 20 или 25 мм рт. ст.) и, как следствие, дыхательном алкалозе, могут при отсутствии мер развиться судороги и быть летальный исход. Особенно неблагоприятен дыхательный алкалоз при гипоксии, т. е. уменьшении снабжения кислородом – при летных происшествиях, к примеру. Гипервентиляция возникает при травмах головы, опухолях мозга, интоксикациях при сепсисе, передозировке салицилатов, печеночной недостаточности.
Респираторный ацидоз
Суть его в накоплении в крови СО2 в результате дыхательной недостаточности. Это гиперкапния и гиповентиляция легких. Она может развиться как следствие нахождения человека в условиях с повышенным содержанием СО2.
С гиповентиляцией связана всегда дыхательная недостаточность, возникающая в результате угнетения дыхательного центра. Причинами патологии являются: инфекции, отравление снотворными, черепно-мозговые травмы, миастения, хронические легочные патологии.
Компенсаторные механизмы, которые организм подключает, пытаясь скорректировать рН до нейтральных значений, никогда не будут действовать с избытком – это контролируется. И означает, например, что при респираторных нарушениях компенсация рН будет стремиться к норме, но никогда не превысит 7,4. Следует заметить, что полная компенсация бывает редко достижимой.
Подсказки
Сдвиги КОС, которые вызвали включение компенсаторных механизмов, всегда первичны, а компенсация – вторична. Надо учитывать, что первичные нарушения показателей при определении кислотно-основного состояния выражены всегда в большей степени, чем компенсаторные, и именно они определяют сдвиг рН в ту или иную сторону.
Корректная трактовка сдвигов первичных и компенсаторных вторичных необходима и обязательна потому, что она определяет дальнейшую адекватную коррекцию этих нарушений, т. е. терапию по оказанию первой помощи и лечения в дальнейшем.
Для исключения ошибок в диагностике кислотно-основного состояния крови, всегда нужно учитывать и PaO2 наряду с другими компонентами нарушения и сочетание с клиническими проявлениями патологии.
Для подсказки: любое первичное нарушение (метаболическое или респираторное), независимо от этиологии, параллельно отклонению pH. А компенсаторный эффект ему противоположен.
Кислотно-основное состояние плазмы крови в оценке ургентных состояний организма в реанимационной практике – крайне важная величина и показатель. Благодаря ему можно спрогнозировать состояние организма при экстремальной ситуации.
Кислотно-основным состоянием (КОС) называется соотношение концентрации водородных и гидроксильных ионов в биологических средах. Регуляторными системами, которые непосредственно обеспечивают постоянство рН крови, являются буферные системы крови и тканей и физиологические системы организма (легкие, почки, печень и желудочно-кишечный тракт).
Показатели КОС
Для оценки состояния КОС используют определение комплекса показателей, основными из которых являются рН и РСО2 крови. Для этих целей широко применяются анализаторы газов крови различных фирм.
рН— величина активной реакции крови.
РСО2 — парциальное давление углекислого газа.Напряжение двуокиси углерода отражает концентрацию углекислоты в крови. Углекислота, входящая в состав бикарбонатного буфера, находится в равновесии с двуокисью углерода, растворенного в крови, а та в свою очередь — с двуокисью углерода воздуха легочных альвеол. Вентиляция легких и свободная диффузия двуокиси углерода из крови в воздух альвеол являются факторами, обусловливающими соответствующие значения РСО2. Изменения РСО2 могут быть результатом нарушения дыхания или доставки углекислоты в легкие.
КонцентрацияHCOJ в крови.НСО^ — вторая составляющая бикарбонатного буфера. В процессе дыхания происходит удаление летучей углекислоты. Почки регулируют концентрацию углеводородов в крови путем реабсорбции и выделения нелетучих углекислот. Изменение концентрации HCOJ может быть результатом метаболических нарушений или почечной декомпенсации.
BE— избыток или дефицит оснований.В результате накопления кислот в организме сумма концентраций буферных анионов крови понижается, а при увеличении щелочей — повышается, образуя так называемые актуальные буферные основания. Разница между актуальной и полагающейся концентрациями буферных оснований указывает на нехватку (-ВЕ) или избыток (+ВЕ) буферных оснований крови. Изменения РСО2 лишь в небольшой степе-
ни оказывают воздействие на концентрацию буферных оснований, поэтому данный параметр позволяет оценивать величину метаболических нарушений или величину метаболической компенсации.
РО2— парциальное давление кислорода.Напряжение кислорода в крови характеризует фракцию растворенного кислорода, которая составляет менее 10 % общего количества кислорода в крови. Однако растворенный кислород находится в динамическом равновесии между кислородом эритроцитов и ткани, поэтому при характеристике гипоксии основным показателем является РО2.
Насыщение гемоглобина кислородом— HbOsat— определяет актуальную степень насыщения гемоглобина кислородом и выражается в процентах относительно суммарной емкости НЬ по связыванию кислорода.
Показатели КОС в норме представлены в табл. 4.47.
Таблица 4.47. Показатели КОС в норме
| Показатель | Артериальная кровь | Венозная кровь |
| рН | 7,36-7,44 | 7,26-7,36 |
| РСОг, мм р.ст. | 36-45 | 46-58 |
| BE, ммоль/л | (-2,3) - (+2,3) | (-2,3) - (+2,3) |
| НСОз, ммоль/л | 22-26 | 24-28 |
| РОг, мм рт.ст. | 80-100 | 37-42 |
| HbOsat, % | 92-98 | 70-76 |
Формы нарушений КОС
Втом случае, когда компенсаторные механизмы организма не способны предотвратить сдвиги концентрации водородных ионов, наступает расстройство КОС. При этом наблюдается два противоположных состояния. Ацидоз характеризуется увеличением концентрации водородных ионов выше нормальных пределов, при этом рН уменьшается. Снижение величины рН ниже 6,8 вызывает смерть. Если концентрация водородных ионов уменьшается (соответственно рН растет), наступает состояние алкалоза. Предел совместимости с жизнью достигается при величине рН 8,0. Нарушения КОС оценивают главным образом на основании определения значений истинного рН, напряжения СО2 и избытка или дефицита оснований в крови. В оценке результатов КОС существуют понятия «компенсированные», «субкомпенси-рованные» и «некомпенсированные нарушения». При компенсированном нарушении КОС абсолютные показатели РСО2 и BE выше или ниже нормальных, но отношения их друг к другу такие же, как в норме, и рН крови не изменяется. При субкомпенсированных нарушениях изменяются КОС и соотношения указанных параметров, но рН остается в пределах нормы. Некомпенсированные нарушения КОС сопровождаются изменением рН крови. При оценке нарушений показателей КОС всегда необходимо помнить, что они тесно взаимосвязаны с водно-электролитным дисбалансом.
Дыхательный (респираторный) ацидоз— избыточное накопление углекислоты в крови в результате недостаточной вентиляционной функции легких или увеличения «мертвого» пространства. Снижение рН ниже нормальных значений свидетельствует о декомпенсирован-ном ацидозе. О компенсации судят по изменению показателей при повторных исследованиях (нормализация рН крови, рост BE и НСО^). Критерии оценки степени тяжести дыхательного ацидоза представлены в табл. 4.48.
Причины гиперкапнии (гиперкарбии):
• недостаточный объем спонтанной вентиляции;
• ошибочный выбор параметров ИВЛ;
• тяжелые двусторонние поражения легких (бронхиальная астма, эмфизема легких и
пневмосклероз).
Таблица 4.48. Критерии оценки степени тяжести дыхательного ацидоза
| Степень тяжести | рН | РСО2 | BE |
| Легкая Средняя Тяжелая | 7,35-7,30 7,29-7,21 7,20 и ниже | 45-50 51-60 Выше 61 | (-2,3)-(+2,3) (-2,3)—(+2,3) (-2,3)-(+2,3) |
Острый дыхательный ацидоз представляет собой наиболее опасное нарушение КОС, развивающееся остро в связи с декомпенсацией функции внешнего дыхания. По мере снижения рН возникают электролитные сдвиги с тенденцией к увеличению фосфатов и калия в плазме. Основная компенсация дыхательного ацидоза осуществляется почками и путем форсированного выведения Н + и хлоридов, а также повышением реабсорбции ионов НСО^, что и находит отражение в увеличении избытка оснований (ВЕ+). Главными в лечении дыхательного ацидоза являются мероприятия, направленные на улучшение легочной вентиляции (искусственная вентиляция легких) и лечение основного заболевания.
Дыхательный (респираторный) алкалоз— снижение количества углекислоты в крови ниже нормы в результате гипервентиляции. Он возникает при резком увеличении дыхательной функции легких. Причины гипокапнии:
• тканевая гипоксия (анемии, шок, сепсис);
• травматические повреждения легких;
• гиперкомпенсация метаболического ацидоза.
Повышение рН выше нормы свидетельствует о декомпенсированном алкалозе. О компенсации судят по изменению показателей при повторных исследованиях (нормализация рН, снижение BE и НСО^). Основной механизм естественной компенсации заключается в усилении экскреции бикарбоната почками и задержке ионов водорода. Компенсацию определяют по соотношению НСО3/РСО2. Критерии оценки степени тяжести дыхательного алкалоза представлены в табл. 4.49.
Таблица 4.49. Критерии оценки степени тяжести дыхательногоалкалоза
| Степень тяжести | рН | РСО2 | BE |
| Легкая Средняя Тяжелая | 7,45-7,48 7,49-7,58 7,59 и выше | 34-28 27-20 19 и ниже | (-2,3)-(+2,3) (-2,3)-(+2,3) (-2,3)—(+2,3) |
Лечение респираторного алкалоза сводится к нормализации дыхания и лечению основного заболевания. Необходимо помнить, что если гипервентиляция устраняется быстро, у больного может развиться метаболический ацидоз вследствие активного включения почечной компенсации.
Метаболический ацидоз— это снижение НСО^ во внеклеточной жидкости, отражающее либо накопление нелетучих кислот, либо потерю оснований. Основные причины накопления ионов Н + в организме следующие:
1) дефицит выведения СО2;
2) неадекватное снабжение клеток кислородом;
3) аномальное образование кислот;
4) неадекватное выведение нециркулирующих кислот.
Метаболический ацидоз возникает в результате:
• диабетического кетоза в связи с накоплением р-оксимасляной кислоты;
• почечной недостаточности в связи с задержкой калия;
• шока как проявления анаэробного метаболизма, развивающегося в связи с неадекват
ной перфузией тканей;
• согревания после гипотермии;
• неадекватной перфузии при искусственном кровообращении;
• длительной непроходимости кишечника;
• окклюзии магистральных артерий;
• как компенсация респираторного алкалоза.
Критерии оценки степени тяжести метаболического ацидоза представлены в табл. 4.50. Таблица 4.50. Критерии оценки степени тяжести метаболического ацидоза
| • Степень тяжести | рн | РСО2 | BE |
| Легкая Средняя Тяжелая | 7,35-7,30 7,29-7,21 7,20 и ниже | 35-45 35-45 35-45 | (-2,3)-(-5,0) (-5,1)—(-10,0) —10,1 и ниже |
Уменьшение рН ниже нормальных значений свидетельствует о декомпенсированном ацидозе. О компенсации судят по изменению показателей при повторных исследованиях (нормализация рН крови и снижение РСО2). Компенсация метаболического ацидоза происходит двумя путями: дыхательным (снижение РСО2) и почечным (выведение Н + и хлоридов, а также повышение реабсорбции ионов НСО^). Для установления патогенетических механизмов метаболического ацидоза и определения правильной тактики ведения больного следует измерить концентрацию электролитов в сыворотке и рассчитать анионный интервал (АИ). Анионный интервал — это косвенная мера анионов в сыворотке, соответствующая разнице между концентрацией натрия и суммой концентраций хлоридов и бикарбоната в сыворотке:
АИ = Na + - (СГ + HCOD-
В норме АИ составляет 12±4 мэкв/л [Вудли М., Уэлан А., 1995]. Все виды метаболического ацидоза, за исключением солянокислого (причина — потеря хлоридов), возникают в результате снижения уровня гидрокарбоната в сыворотке без соответствующего повышения концентрации ионов хлора, т.е. сопровождаются увеличением АИ. Существенную информацию о происхождении метаболического ацидоза могут дать исследования осмолярности плазмы и определение концентрации лактата в крови.
Лечение метаболического ацидоза проводят внутривенным введение 4,2 % раствора NaHCO3 (бикарбонат). Расчет проводят по формуле:
4,2 % раствор NaHCO3, мл = 0,3 х BE x M (масса тела больного, кг).
При введении больному бикарбоната необходимо помнить, что лучше недолить его внутривенно, чем перелить, поэтому после введения большей части раствора необходимо повторное исследование КОС; если рН достигла 7,2, введение бикарбоната необходимо прекратить, если нет — продолжить. Следует помнить, что метаболический ацидоз сопровождается внутриклеточной гиперкалиемией и гипокалиемией в сыворотке, поэтому таким больным показан контроль за уровнем калия в сыворотке. Если при коррекции ацидоза уровень калия начинает падать, необходимо вводить его внутривенно. Нужно следить и за уровнем кальция в сыворотке, поскольку относительный алкалоз, возникающий при коррекции метаболического ацидоза, может снизить концентрацию ионизированного кальция. Таким больным показано переливание свежей крови, так как со свежей кровью в организм поступает бикарбонат.
Метаболический алкалоз— это первичный избыток оснований с BE выше нормы, приводящим к повышению рН крови. Он возникает в результате:
• потерь Н + и СП через желудочно-кишечный тракт;
• потерь К + (цирроз печени, диуретики);
• увеличения НСО^ из-за введения щелочных растворов, метаболизации цитрата, гипер
компенсации респираторного ацидоза, потерь внеклеточной жидкости.
Критерии оценки степени тяжести метаболического алкалоза представлены в табл. 4.51.
Таблица 4.51. Критерии оценки степени тяжести метаболического алкалоза
| Степень тяжести | РН | РСО2 | BE |
| Легкая Средняя Тяжелая | 7,45-7,48 7,49-7,58 7,59 и выше | 35-45 35-45 35-45 | от +2,3 до + 5,0 » +5,1 » +10,0 + 10,1 и выше |
Увеличение рН выше нормальных значений свидетельствует о декомпенсированном алкалозе. О компенсации судят по изменению показателей при повторных исследованиях (нормализация рН и рост РСО2). Всегда необходимо помнить, что нет алкалоза без снижения СП и К + в крови, поэтому таким больным при коррекции алкалоза показано определение электролитов в сыворотке каждые 4 ч. Весьма важным при выработке тактики лечения больных с метаболическим алкалозом является определение уровня хлоридов в моче (см. раздел «Хлор в моче»).
Лечение метаболического алкалоза должно включать комплекс мероприятий: кислую диету (белковую), назначение слабых растворов соляной кислоты внутрь (восстановление потерь ионов хлора), внутривенное введение аскорбиновой кислоты в больших количествах, КС1 (компенсация гипокалиемии и гипохлоремии), NaCl, назначение препаратов, ингибирующих карбоангидразу, — диакарб (блокирует реабсорбцию НСО^ почками). При лечении больных с метаболическим алкалозом необходимо контролировать рН мочи. Если рН мочи щелочная, это говорит о компенсированном алкалозе, если кислая — то лечебные мероприятия необходимо интенсифицировать и постараться перевести рН мочи из кислой в щелочную.
Смешанные нарушения КОС
Смешанные нарушения КОС (табл. 4.52) обычны в острой стадии заболеваний и часто предсказуемы на основании клинического состояния. Необходима тщательная оценка компенсаторных изменений рН, РСО2 и НСО3. Определение АИ у больных со смешанными нарушениями КОС позволяет установить патогенетические механизмы метаболического ацидоза. Наиболее опасны однонаправленные сдвиги КОС: дыхательный и метаболический ацидоз, дыхательный и метаболический алкалоз, приводящие к значительным изменениям рН. Лечение смешанных нарушений КОС должно быть направлено на устранение вызывающих их процессов.
Таблица 4.52. Клинические формы смешанных нарушений КОС
| Нарушения | рН | РСО2 | BE | |||
| Дыхательный | и метаболический ацидоз | 7,30 и ниже | 46,0 и выше | -2 | ,3 | и ниже |
| Дыхательный | и метаболический алкалоз | 7,50 и выше | 34,0 и ниже | +2 | ,3 | и выше |
| Дыхательный | ацидоз и метаболический алкалоз | 7,30-7,48 | 46,0 и выше | +2 | ,3 | и выше |
| Дыхательный | алкалоз и метаболический ацидоз | 7,30-7,48 | 34,0 и ниже | -2 | ,3 | и ниже |
Дыхательный и метаболический ацидозможет развиться у больного сразлитым гнойным перитонитом в раннем послеоперационном периоде, притяжелой форме ДВС-синдрома, «шоковом» легком, диабетической коме, в предтерминальном состоянии любой этиологии. В большинстве случаев эти нарушения носят декомпенсированный характер (рН 7,50), РСО2 резко падает, BE устойчиво повышается. Для правильной коррекции дыхательного и метаболического алкалоза необходимо вначале уточнить характер электролитных нарушений (чаще всего — внутриклеточный дефицит калия) и затем провести их коррекцию.
Дыхательный ацидоз и метаболический алкалоз— очень неблагоприятное нарушение КОС, так как оба сдвига синергично ухудшают состояние больного, поскольку накопление СО2, являющееся элементом компенсации метаболического алкалоза, стимулирует дыхательный центр, вызывая гипервентиляцию и вторичное нарастание алкалоза.
Дыхательный алкалоз и метаболический ацидозотносят к наиболее частым разнонаправленным нарушениям КОС. При данном виде нарушений, до тех пор, пока гипервентиляция компенсирует ацидотические сдвиги и рН крови остается в пределах нормы, лечение должно быть направлено на коррекцию метаболизма и тканевой гипоксии.
![]()





217 0
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ САМАРСКОЙ ОБЛАСТИ
ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ САМАРСКОЙ ОБЛАСТИ
«САМАРСКИЙ МЕТАЛЛУРГИЧЕСКИЙ КОЛЛЕДЖ»
КОМПЛЕКТ КОНТРОЛЬНО – ОЦЕНОЧНЫХ СРЕДСТВ ПО ОУП.11.ХИМИЯ
ПРОГРАММЫ ПОДГОТОВКИ КВАЛИФИЦИРОВАННЫХ РАБОЧИХ, СЛУЖАЩИХ
по специальности 15.02.08 Технология машиностроения
Курс обучения I
Форма обучения очная
Методической предметной (цикловой) комиссией естественно-научных дисциплин:
Протокол № __ от «___» _________ 2019г.
Председатель методической предметной (цикловой) комиссии: _________________________/Яковлева К.С./
Заместитель директора по учебной работе
_____________/ Жаркова Т.А./
Комплект контрольно-оценочных средств учебной дисциплины разработан на основе
Федерального государственного образовательного стандарта (далее – ФГОС) 15.02.08 технология машиностроения, утвержденного приказом Министерства образования и науки Российской Федерации от 02 августа 2013 г. N 822,
рабочей программы учебной дисциплины.
Разработчик: Е.Н.Григоревская, преподаватель ГАПОУ «СаМеК»
1. Паспорт комплекта контрольно-оценочных средств
1.1. Общие положения
Контрольно-оценочные средства (КОС) предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебного предмета. КОС включают контрольные материалы для проведения промежуточной аттестации в форме дифференцированного зачета.
1.2. Результаты освоения учебной дисциплины
В результате аттестации по учебному предмету осуществляется комплексная проверка следующих умений и знаний, а также динамика формирования общих и профессиональных компетенций:
1.21. В процессе освоения предмета у студентов должны формироваться общие компетенции (ОК):
ОК 1. Понимать сущность и социальную значимость будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, исходя из цели и способов ее достижения, определенных руководителем.
ОК 3. Анализировать рабочую ситуацию, осуществлять текущий и итоговый контроль, оценку и коррекцию собственной деятельности, нести ответственность за результаты своей работы.
ОК 4. Осуществлять поиск информации, необходимой для эффективного выполнения профессиональных задач.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в команде, эффективно общаться с коллегами, руководством, клиентами.
ОК 7. Исполнять воинскую обязанность, в том числе с применением полученных профессиональных знаний (для юношей).
1.22. Оцениваемые образовательные результаты
В результате освоения учебного предмета «Химия» обучающийся должен уметь:
- называть: изученные вещества по тривиальной или международной номенклатуре;
-определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических и органических соединений, окислитель и восстановитель, принадлежность веществ к разным классам неорганических и органических соединений;
- характеризовать: элементы малых периодов по их положению в Периодической системе Д.И. Менделеева; общие химические свойства металлов, неметаллов, основных классов неорганических и органических соединений; строение и химические свойства изученных неорганических и органических соединений;
- объяснять: зависимость свойств веществ от их состава и строения, природу химической связи (ионной ковалентной, металлической и водородной), зависимость скорости химической реакции и положение химического равновесия от различных факторов.
- выполнять химический эксперимент: по распознаванию важнейших неорганических и органических соединений;
- проводить: самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
- связывать: изученный материал со своей профессиональной деятельностью;
- решать: расчетные задачи по химическим формулам и уравнениям;
- важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, аллотропия, изотопы, химическая связь, электроотрицательность, валентность, степень окисления, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения, растворы, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, изомерия, гомология;;
- основные законы химии: сохранения массы веществ, постоянства состава веществ, Периодический закон Д.И. Менделеева;
- основные теории химии; химической связи, электролитической диссоциации, строения органических и неорганических соединений;
- важнейшие вещества и материалы: важнейшие металлы и сплавы; серная, соляная, азотная и уксусная кислоты; благородные газы, водород, кислород, галогены, щелочные металлы; основные, кислотные и амфотерные оксиды и гидроксиды, щелочи, углекислый и угарный газы, сернистый газ, аммиак, вода, природный газ, метан, этан, этилен, ацетилен, хлорид натрия, карбонат и гидрокарбонат натрия, карбонат и фосфат кальция, бензол, метанол и этанол, сложные эфиры, жиры, мыла, моносахариды (глюкоза), дисахариды (сахароза), полисахариды (крахмал и целлюлоза), анилин, аминокислоты, белки, искусственные и синтетические волокна, каучуки, пластмассы;
1.22. Результаты освоения учебной дисциплины, подлежащие проверке
М. Ю. Корнилов
доктор химических наук
«Химия и жизнь» №6, 2007
Наверное, каждый человек от мала до велика умеет заплетать косу из трех прядей волос или веревок. На рисунке показана коса из конопляных канатов: ее ширина — три сантиметра, толщина — один.

Косы, как и узлы и некоторые другие изделия из нитей и полос бумаги, служат объектами математических исследований с точки зрения их топологии — геометрической структуры, которая не меняется при непрерывной деформации, в частности при растягивании или выворачивании наизнанку. Например, правая и левая перчатки, как и любой другой предмет и его зеркальное изображение, имеют одинаковую топологию, а кольцо и узел, два отдельных кольца и кольца, соединенные подобно звеньям цепи, — разную.
А вот углеродные косы из карбиновых нитей, то есть нитевидных молекул углерода, — это нечто новое по своим масштабам, хотя топология их не нова. О таких химических косах пойдет далее речь. На следующем рисунке мы видим модель простейшей косы, сплетенной с помощью «химического конструктора» из трех карбиновых нитей.

Изображены три ортогональные (взаимно перпендикулярные) проекции карбиновой косы (ширина 0,7 нм, высота 0,4 нм): вид сверху (а), сбоку (б), с торца (в).
Для сравнения еще на одном рисунке показаны ортогональные проекции шнурка из трех карбиновых нитей (диаметр шнурка 0,4 нм).

Сравнение последних двух рисунков позволяет видеть, чем существенно отличается коса от шнурка, в котором нити скручены, а не переплетены. У шнурка проекции а и б тождественны, а у косы они разные. Это отличие проявляется особенно наглядно, если косу и шнурок свернуть в кольцо. На рисунках показаны: а — карбиновое кольцо С1008 в форме шайбы (Ш) и обруча (О) диаметром 10,8 нм; б — кольцо-шнурок С828 , его диаметр 8,5 нм.

Для косы возможны два геометрически разных, хотя и топологически одинаковых случая. Если сворачивать кольцо в одной плоскости, получается структура, напоминающая шайбу, а если в другой — обруч. На первом рисунке показаны проекции кольца-шайбы и кольца-обруча сверху и сбоку, а на втором — то же для кольца из карбинового шнурка.
Как были построены такие кольца? Каждое из них собирали из 12 одинаковых линейных фрагментов, ориентированных в плоскости под углами 30 о друг к другу и затем соединенных между собой. Для правильной стыковки фрагментов косы и последующей оптимизации ее геометрии необходимо, чтобы в кольце было целое число «волн» каждой карбиновой нити. В случае шнурка это требование значения не имеет.
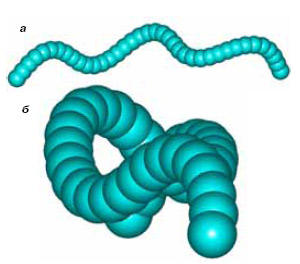
У читателя, знакомого со стереохимией, может возникнуть вопрос: хиральны ли углеродные косы и кольца из них? Как и любая пространственная спираль, шнурок, составленный из однонаправленных спиральных нитей, всегда хирален. Может показаться, что и кольца-косы, построенные из закрученных карбиновых нитей, которые, как синусоида, извиваются в плоскости кольца и к тому же виляют в перпендикулярном направлении, также должны быть хиральными. На следующем рисунке показаны ортогональные проекции фрагмента обруча: вид сбоку (а) и с торца (б).
Тем не менее сравнение каждой такой нити и всего кольца в целом с их зеркальными отражениями дает парадоксальный результат: у кольца-обруча они тождественны, а у его «геометрического изомера» — кольца-шайбы — разные! Таким образом, структура (Ш) хиральная, а (О) — нет. Путем «выворачивания наизнанку» структуру (Ш) можно перевести в соответствующий энантиомер, который будет ее зеркальным изображением. При этом на промежуточном этапе образуется ахиральная структура (О) — полная аналогия с энантиомерными молекулами и плоским, ахиральным переходным состоянием. Что касается линейной косы, то она ахиральна только тогда, когда состоит, как и кольцо, из целого числа «волн» или имеет бесконечную длину.
Заплетание модели карбиновой косы оказалось делом непростым. Карбиновые нити, стремящиеся в идеале быть линейными, всячески противятся изгибанию, при оптимизации геометрии распрямляются и выскальзывают из зацеплений. Решение проблемы было найдено в результате анализа устройства косы, заплетенной из канатов: она состоит из повторяющихся волнообразных фрагментов. Ниже показаны этапы сборки и оптимизации геометрии косы из трех карбиновых нитей (в каждой паре рисунков верхний — вид сверху, нижний — вид сбоку): (а) две плоские полуокружности из 12 атомов углерода; (б) зигзагообразная цепь из 16 полуокружностей; (в) скелет косы из трех сложенных цепей до оптимизации геометрии; (г) «одетая» коса до оптимизации и (д) после оптимизации геометрии (незакрепленные концы разошлись).

На первом этапе делаем такой фрагмент из карбинового 12-угольника, который оптимизируем, затем разрываем одну из связей и поворачиваем одну половину на 180° относительно противоположной связи (рис. а). Далее составляем зигзагообразную цепь из таких фрагментов (рис. б), добавляем к ней две такие же копии и размещает их на равных расстояниях вдоль направления цепи (рис. в). Это уже коса, хотя еще «сырая». В ней карбиновые нити заплетены как нужно и нигде не пересекаются (рис. г), но имеют угловатую структуру. При оптимизации геометрии модель косы быстро приобретает округлые формы. Концы, если они не закреплены, начинают распрямляться и расходиться (рис. д).

Закрепить концы косы можно вспомогательными фрагментами. Этот способ напоминает известный прием: чтобы косы не расплетались, их перехватывают резиновыми колечками или завязывают ленточками.

Описанный прием позволяет собрать косы, а из них кольца из любого числа нитей. Правило моделирования здесь такое: число полуокружностей, из которых делается первоначальный 12-атомный фрагмент косы (рис. а), должно быть на единицу меньше числа карбиновых нитей (так, для косы из трех нитей было взято две полуокружности, из четырех нитей — три полуокружности и т. д.). Далее показаны косы из трех, четырех и пяти карбиновых нитей. Для наглядности одна из нитей другого цвета. Справа показаны косы с торца.
Подобным образом из карбиновых нитей можно изготовить широкую косу — коврик. На рисунке показаны: (а) заготовка и отдельная нить карбинового коврика, (б) — то же после оптимизации геометрии; (в) фрагмент оптимизированного коврика.

Форма каждой нити заготовки коврика, как и в случае косы, имеет вид волнистой линии (рис. а). Чтобы нити не распрямлялись, их концы попарно соединяют по контуру. После оптимизации геометрии коврика прямоугольная сетка плоских нитей превращается в сетку трехмерных спиралей (рис. б, в). Кольца из карбинового шнурка оказываются нестабильными. При оптимизации геометрии они постепенно деформируются, утрачивают круглую форму и превращаются в спутанный клубок, который напоминает «фараоновы змеи».
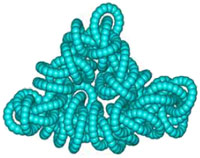
На этом рисунке показан результат оптимизации геометрии нестабилизированного шнурка из трех карбиновых нитей. Подобным же образом ведут себя кольцевые спирали из нанотрубок (см. «Химию и жизнь», 2005, № 9).
У колец из кос такого не происходит: переплетенные, а не скрученные карбиновые нити стабилизируют друг друга. Для стабилизации кольца из шнурка достаточно вставить вдоль его оси еще одно карбиновое кольцо.

На рисунке показана стабилизация кольца С828, сделанного из шнурка, соосным кольцом С208 из одной незакрученной карбиновой нити. Такой «комплекс» оптимизируется, образуя кольца правильной формы.

Описанным ранее методом косу удается завязать в узел. Вот на следующем рисунке показан узел-трилистник С1008 из карбиновой косы — топологический изомер карбиновых колец. Математики называют такую фигуру «клеверным листом» и обозначают как 31.
Кольца можно соединить в катенаны или другие переплетения.

Топология таких «комплексов» отличается от топологии отдельно взятых колец. Вначале показан тройной катенан: каждое кольцо С1008 продето через два других. Если разорвать любое кольцо, два других остаются соединенными. Вторая структура отличается от предыдущей способом соединения: те же самые кольца соединены так, что все три держатся вместе. Достаточно убрать любое из них — два оставшихся будут просто лежать друг на друге.
Можно сплести модель кольца из одной-единственной карбиновой нити.
На последнем рисунке показано кольцо С3150 из косы, заплетенной из одной карбиновой нити (диаметр кольца (б) 22,2 нм). В увеличенном виде показано, как выглядит коса по разные стороны от плоскости (а, в) и с торца кольца (г). Подобное плетение образует нить в швейных, сапожных и некоторых производственных машинах, у которых нет челнока. Предлагаем читателю решить, хиральны структуры трилистника и кольца из карбиновой нити или нет.

Таким образом, нити карбина могут быть уникальным материалом для «ткацких» изделий молекулярного уровня. Дело за современными Жаккарами и Зингерами, изобретателями ткацкого наностанка и швейной наномашинки.
Молекулярные шнурки более сложного, чем у карбина, строения известны давно, их заплетает ее величество Природа — это спиральные макромолекулы амилозы, ДНК и т. д. Не исключено, что и косы уже существуют в природе на молекулярном уровне, если не в виде колец, узлов или катенанов, то, по крайней мере, в незамкнутом виде. Но они пока еще не попали в поле зрения ученых и ждут своего звездного часа.
Политехнический колледж (г. Магнитогорск)
Комплект контрольно-оценочных средств предназначен для проверки результатов освоения учебной дисциплины ОП.02 Органическая химия основной профессиональной образовательной программы по специальности СПО 18.02.01 Аналитический контроль качества химических соединений
Комплект контрольно-оценочных средств для проведения промежуточного контроля позволяет оценивать:
Формирование элементов профессиональных компетенций (ПК) и элементов общих компетенций (ОК):
ПК 1.1. Оценивать соответствие методики задачам анализа по диапазону измеряемых значений и точности.
ПК 1.2. Выбирать оптимальные методы анализа.
ПК 1.3. Оценивать экономическую целесообразность использования методов и средств анализа и измерений.
ПК 2.1. Обслуживать и эксплуатировать оборудование химико-аналитических лабораторий.
ПК 2.2. Подготавливать реагенты и материалы, необходимые для проведения анализа.
ПК 2.3. Обслуживать и эксплуатировать коммуникации химико-аналитических лабораторий.
ПК 2.4. Проводить качественный и количественный анализ неорганических и органических веществ химическими методами и др.


Copyright © 2010—2021
ООО «Современные медиа технологии в образовании и культуре»
Поддержка
(495) 589-87-71
Сервис «Комментарии» - это возможность для всех наших читателей дополнить опубликованный на сайте материал фактами или выразить свое мнение по затрагиваемой материалом теме.
Редакция Информио.ру оставляет за собой право удалить комментарий пользователя без предупреждения и объяснения причин. Однако этого, скорее всего, не произойдет, если Вы будете придерживаться следующих правил:
- Не стоит размещать бессодержательные сообщения, не несущие смысловой нагрузки.
- Не разрешается публикация комментариев, написанных полностью или частично в режиме Caps Lock (Заглавными буквами). Запрещается использование нецензурных выражений и ругательств, способных оскорбить честь и достоинство, а также национальные и религиозные чувства людей (на любом языке, в любой кодировке, в любой части сообщения - заголовке, тексте, подписи и пр.)
- Запрещается пропаганда употребления наркотиков и спиртных напитков. Например, обсуждать преимущества употребления того или иного вида наркотиков; утверждать, что они якобы безвредны для здоровья.
- Запрещается обсуждать способы изготовления, а также места и способы распространения наркотиков, оружия и взрывчатых веществ.
- Запрещается размещение сообщений, направленных на разжигание социальной, национальной, половой и религиозной ненависти и нетерпимости в любых формах.
- Запрещается размещение сообщений, прямо либо косвенно призывающих к нарушению законодательства РФ. Например: не платить налоги, не служить в армии, саботировать работу городских служб и т.д.
- Запрещается использование в качестве аватара фотографии эротического характера, изображения с зарегистрированным товарным знаком и фотоснимки с узнаваемым изображением известных людей. Редакция оставляет за собой право удалять аватары без предупреждения и объяснения причин.
- Запрещается публикация комментариев, содержащих личные оскорбления собеседника по форуму, комментатора, чье мнение приводится в статье, а также журналиста.
Претензии к качеству материалов, заголовкам, работе журналистов и СМИ в целом присылайте на адрес
Информация доступна только для зарегистрированных пользователей.
Уважаемые коллеги. Убедительная просьба быть внимательнее при оформлении заявки. На основании заполненной формы оформляется электронное свидетельство. В случае неверно указанных данных организация ответственности не несёт.
Читайте также:

